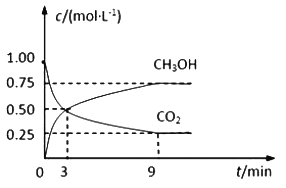
【题目】化学学习小组在实验室中对铁盐与亚铁盐的相互转化进行如下探究。
已知:SCN-具有强还原性,易被氧化为(SCN)2。
实验Ⅰ:Fe3+转化为Fe2+
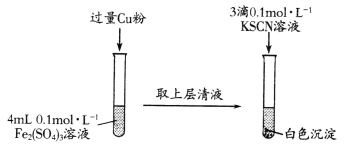
(1)Fe2(SO4)3溶液与Cu粉发生反应的离子方程式为________________________。
(2)探究白色沉淀产生的原因:
①提出假设:
假设1:白色沉淀是Fe2+与SCN-直接结合所得;
假设2:白色沉淀是Cu2+与SCN-直接结合所得;
假设3:_____________________________________________。
②实验验证:
向CuSO4溶液中通人过量SO2,将Cu2+还原,再加入KSCN溶液,观察到有白色沉淀生成,证明假设三成立。写出CuSO4溶液与KSCN溶液反应的离子方程式:________。
实验Ⅱ:Fe2+转化为Fe3+
实验方案 | 现象 |
向3mL 0.1mol·L-1 FeSO4溶液中加入3mL 4mol·L-1稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
(3)实验Ⅱ中,Fe2+转化为Fe3+的离子方程式是_____________________________。
(4)设计如下实验,探究溶液变为棕色的原因:
①向Fe2(SO4)3溶液中通入NO,溶液颜色无变化
②向FeSO4溶液中通入NO,溶液颜色变为棕色
③向Fe(NO3)3溶液中通入NO,溶液颜色无变化
由上述实验分析溶液变为棕色的原因是_________________________________________。