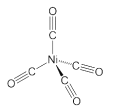
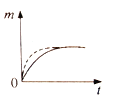
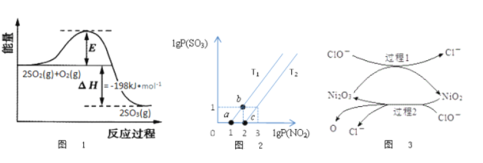
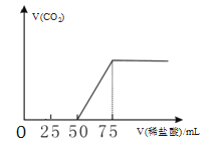
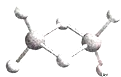
0 197431 197439 197445 197449 197455 197457 197461 197467 197469 197475 197481 197485 197487 197491 197497 197499 197505 197509 197511 197515 197517 197521 197523 197525 197526 197527 197529 197530 197531 197533 197535 197539 197541 197545 197547 197551 197557 197559 197565 197569 197571 197575 197581 197587 197589 197595 197599 197601 197607 197611 197617 197625 203614