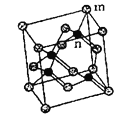
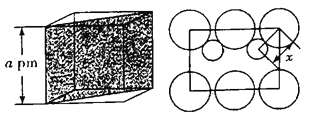
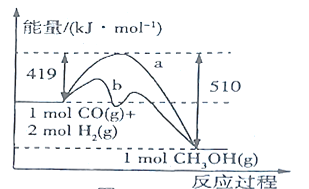
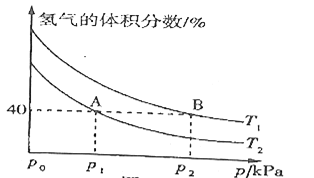
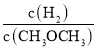【题目】某研究性学习小组类比镁在二氧化碳中的燃烧反应,认为钠和二氧化碳也可以发生反应,他们对钠在CO2气体中燃烧进行了下列实验:
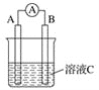
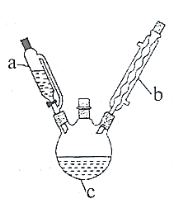
(1)若用下图装置制备CO2,则发生装置中反应的离子方程式为_________。
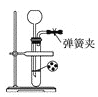
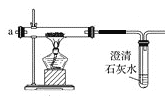
(2)将制得的CO2净化、干燥后由a口缓缓通入下图装置,待装置中的空气排净后点燃酒精灯,观察到玻璃直管中的钠燃烧,火焰为黄色。待冷却后,管壁附有黑色颗粒和白色物质。
①能说明装置中空气已经排净的现象是_________。
②若未排尽空气就开始加热,则可能发生的化学反应方程式主要为_________。
(3)若钠着火,可以选用的灭火物质是_________。
A.水 B.泡沫灭火剂 C.干沙土 D.二氧化碳
(4)该小组同学对管壁的白色物质的成分进行讨论并提出假设:
Ⅰ.白色物质可能是Na2O; Ⅱ.白色物质可能是Na2CO3; Ⅲ.白色物质还可能是_________。
(5)为确定该白色物质的成分,该小组进行了如下实验:
实验步骤 | 实验现象 |
①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加过量的CaCl2溶液 | 出现白色沉淀 |
②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
①通过对上述实验的分析,你认为上述三个假设中,___成立(填序号)。
②由实验得出:钠在CO2中燃烧的化学方程式为_____;每生成1mol氧化产物,转移的电子数为____。
(6)在实验(2)中还可能产生另一种尾气,该气体为________;处理该尾气的方法为_____。
【题目】乙酰苯胺(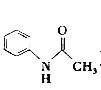 )在工业上可用作橡胶硫化促进剂、纤维酯涂料的稳定剂、过氧化氢的稳定剂等,可通过苯胺(
)在工业上可用作橡胶硫化促进剂、纤维酯涂料的稳定剂、过氧化氢的稳定剂等,可通过苯胺(![]() )和乙酸酐(
)和乙酸酐(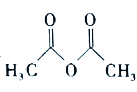 )反应制得。已知:纯乙酰苯胺是白色片状晶体,相对分子质量为135,熔点为
)反应制得。已知:纯乙酰苯胺是白色片状晶体,相对分子质量为135,熔点为![]() ,易溶于有机溶剂。在水中的溶解度如下。
,易溶于有机溶剂。在水中的溶解度如下。
温度/℃ | 20 | 25 | 50 | 80 | 100 |
溶解度/( | 0.46 | 0.56 | 0.84 | 3.45 | 5.5 |
实验室制备乙酰苯胺的步骤如下(部分装置省略):
Ⅰ.粗乙酰苯胺的制备。将![]() 乙酸酐放入三口烧瓶
乙酸酐放入三口烧瓶![]() 中,在
中,在![]() 中放入
中放入![]() 新制得的苯胺。将苯胺在室温下逐滴滴加到三口烧瓶中。苯胺滴加完毕,在石棉网上用小火加热回流
新制得的苯胺。将苯胺在室温下逐滴滴加到三口烧瓶中。苯胺滴加完毕,在石棉网上用小火加热回流![]() ,使之充分反应。待反应完成,在不断搅拌下,趁热把反应混合物缓慢地倒入盛有
,使之充分反应。待反应完成,在不断搅拌下,趁热把反应混合物缓慢地倒入盛有![]() 冷水的烧杯中,乙酰苯胺晶体析出。充分冷却至室温后,减压过滤,用______洗涤晶体2-3次。用滤液冲洗烧杯上残留的晶体,再次过滤,两次过滤得到的固体合并在一起。
冷水的烧杯中,乙酰苯胺晶体析出。充分冷却至室温后,减压过滤,用______洗涤晶体2-3次。用滤液冲洗烧杯上残留的晶体,再次过滤,两次过滤得到的固体合并在一起。
Ⅱ.乙酰苯胺的提纯。将上述制得的粗乙酰苯胺固体移入![]() 烧杯中,加入
烧杯中,加入![]() 热水,加热至沸腾,待粗乙酰苯胺完全溶解后,再补加少量蒸馏水。稍冷后,加入少量活性炭吸附色素等杂质,在搅拌下微沸
热水,加热至沸腾,待粗乙酰苯胺完全溶解后,再补加少量蒸馏水。稍冷后,加入少量活性炭吸附色素等杂质,在搅拌下微沸![]() ,趁热过滤。待滤液冷却至室温,有晶体析出,______、______,干燥后称量产品为
,趁热过滤。待滤液冷却至室温,有晶体析出,______、______,干燥后称量产品为![]() 。
。
回答下列问题:
(1)仪器![]() 的名称是______________。
的名称是______________。
(2)写出制备乙酰苯胺的化学方程式______________。
(3)步聚I中,减压过滤的优点是_____;用滤液而不用蒸馏水冲洗烧杯的原因是_________;洗涤晶体最好选用________(填字母)。
A.乙醇 B.![]() C.冷水 D.乙醚
C.冷水 D.乙醚
(4)步骤Ⅱ中,粗乙酰苯胺溶解后,补加少量蒸馏水的目的是______________。
(5)步骤Ⅱ中,干燥前的操作是______________。上述提纯乙酰苯胺的方法叫_____________。
(6)乙酰苯胺的产率为______________。(计算结果保留3位有效数字)