【题目】农业对化肥的需求是合成氨工业发展的持久推动力。在一容积为2 L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应:
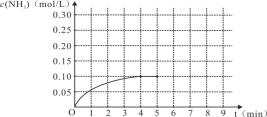
(1)N2(g)+3H2(g)![]() 2NH3(g),反应中NH3的物质的量浓度的变化情况如右图,根据图像,计算从反应开始到平衡时,氮气的平均反应速率为___________________。
2NH3(g),反应中NH3的物质的量浓度的变化情况如右图,根据图像,计算从反应开始到平衡时,氮气的平均反应速率为___________________。
(2)该温度下,反应N2(g)+3H2(g)![]() 2NH3(g)+ Q(Q>0)的平衡常数表达式为__________。
2NH3(g)+ Q(Q>0)的平衡常数表达式为__________。
其平衡常数K与温度T的关系如下表:
T/℃ | 25 | 125 | 225 |
平衡常数K | 4×106 | K1 | K2 |
试判断K1______ K2(填写“>”“=”或“<”)。原因是_________________________________
(3)下列能说明合成氨反应已达到平衡状态的是________(填字母)(反应是在固定体积的密闭容器中进行的)
a.3v(N2) = v(H2) b. ![]() 不发生变化 c.混合气体的密度保持不变
不发生变化 c.混合气体的密度保持不变
d.25℃时,测得容器中 c(NH3)=0.2 mol·L-1, c(H2) =c(N2) =0.01 mol·L-1
(4) 催化剂存在下,NH3可用来消除NO的污染,生成两种对环境无害的物质。写出反应的化学方程式并标出电子转移的方向和数目:____________;该反应中氧化产物与还原产物的物质的量之比为____。
(5) pH相同的氨水和氢氧化钠溶液,分别用蒸馏水稀释至原来体积的m倍和n倍,稀释后两溶液的pH仍相同,则m________n(填“>”、“<”或“=”)
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了酸性高锰酸钾与草酸的反应,记录以下实验数据:
实验编号 | 实验温度 | 试管中所加试剂及其用量 / mL | 溶液褪至无色所需时间/ min | |||
0.6mol/L H2C2O4 溶液 | H2O | 3mol/L H2SO4 稀溶液 | 0.05mol/L KMnO4溶液 | |||
① | 25 | 3.0 | V1 | 2.0 | 3.0 | 1.5 |
② | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
③ | 50 | 2.0 | V2 | 2.0 | 3.0 | 1.0 |
(1)请写出该反应的离子方程式_________,当该反应以表中数据反应完全时转移电子数为_______NA;
(2)V1=________ mL;
(3)根据上表中的实验①、②数据,可以得到的结论是________。
(4)探究温度对化学反应速率的影响,应选择________(填实验编号);
(5)该小组同学根据经验绘制了n(Mn 2+)随时间变化的趋势如图所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn 2+)随时间变化的实际趋势如图所示。
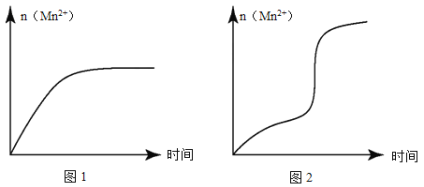
该小组同学根据如图所示信息提出了新的假设,并设计以下实验方案继续进行实验探究。
实验编号 | 实验温度/℃ | 试管中所加试剂及其用量 | 再加入某种固体 | 溶液褪至无色所需时间 / min | |||
④ | 25 | 0.6mol/L H2C2O4 | H2O | 3mol/L H2SO4 | 0.05mol/L KMnO4溶液 | ||
2.0 | 3.0 | 2.0 | 3.0 | MnSO4 | t | ||
①小组同学提出的假设是_________。
②若该小组同学提出的假设成立,应观察到_______________________现象。