【题目】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色黏稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
称取A 9.0 g,升温使其汽化,测其密度是相同条件下H2的45倍。 | 试通过计算填空: |
(1)A的相对分子质量为:________。 | |
(2)将此9.0 g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4 g和13.2 g | (2)A的分子式为:________。 |
(3)另取A 9.0 g,跟足量的NaHCO3粉末反应,生成2.24 L CO2(标准状况),若与足量金属钠反应则生成2.24 L H2(标准状况) | (3)写出A中含有的官能团____________、________。 |
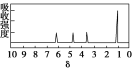
(4)A的核磁共振氢谱如下图: | A中含有4种氢原子。 |
(4)综上所述,A的结构简式为________。 | |
【题目】实验室用CH3CH2OH分两步制备1,2-二溴乙烷现用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如下图所示:
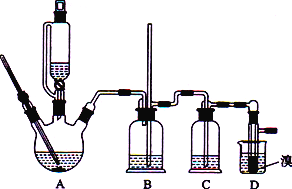
有关数据列表如下:
物质名称 | 乙醇 | 1,2-二溴乙烷 | 乙醚 |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/(g·cm-3) | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)装置A中发生的化学方程式为_________________________________,反应类型为________,在此制备实验中,要尽可能迅速地把反应温度提高到170 ℃左右,其最主要目的是________(填字母)。
a 引发反应 b减少副产物乙醚生成 c 防止乙醇挥发 d加快反应速率
(2)在装置C中应加入________(填字母),其目的是吸收反应中可能生成的酸性气体。
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3) 装置D中实验现象为_______________。
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在________(填“上”或“下”)层。
(5)反应过程中应用冷水冷却装置D,其主要目的是____________________________。
【题目】利用化学原理对工厂排放的废水、废渣等进行有效检测与合理处理。
某工厂对制革工业污泥中Cr元素的回收与再利用工艺如图(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+):

常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | - | - | - |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 9(>9溶解) |
(1) 酸浸时,为了提高浸取率可采取的措施是____(至少写两条)。
(2)H2O2的作用是_____。
(3)调pH=8是为了除去___(填Fe3+、Fe2+、Al3+、Ca2+、Mg2+)。
(4)钠离子交换树脂的原理为Mn++nNaR→MRn+nNa+,被交换的杂质离子是___(填Fe3+、Fe2+、Al3+、Ca2+、Mg2+)。
(5)已知以下氧化还原反应方程式(未配平):Na2Cr2O7+SO2+H2O=Cr(OH)(H2O)5SO4+Na2SO4;以上反应各物质的配平系数依次为___。每生成1 mol Cr(OH)(H2O)5SO4转移电子的数目为___。