题目内容
【题目】下列图象与对应实验操作相符合的是( )
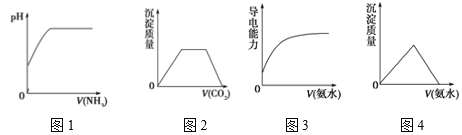
A. 图1 表示在水中慢慢通入氨气至过量
B. 图2表示在氢氧化钠和偏铝酸钠混合溶液中通入二氧化碳至过量
C. 图3表示在醋酸溶液中慢慢滴加同浓度的氨水至过量
D. 图4表示在氯化铝溶液中滴加氨水至过量
【答案】A
【解析】
A.氨气通入水中,氨气和水反应生成一水合氨,一水合氨电离出铵根离子和氢氧根离子,溶液中氨气饱和,PH不再变化;
B.向NaOH和Ca(OH)2的混合溶液中通入CO2,先发生Ca(OH)2+CO2═CaCO3↓+H2O,再发生CO2+NaOH═NaHCO3,最后发生CaCO3↓+H2O+CO2═Ca(HCO3)2;
C.溶液导电能力的强弱主要取决于阴、阳离子浓度的大小,离子浓度越大,导电能力越强,乙酸与氨水反应生成乙酸铵,乙酸铵属于强电解质,但氨水至过量,导电能力减弱;
D.向氯化铝溶液中滴加氨水,由于生成的氢氧化铝不溶于氨水弱碱,沉淀不溶解。
A.氨气通入水中,NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-,氨气未饱和前,溶液的PH在不断增大,当溶液饱和时,PH不再变化,故A正确;
NH4++OH-,氨气未饱和前,溶液的PH在不断增大,当溶液饱和时,PH不再变化,故A正确;
B.因向NaOH和Ca(OH)2的混合液中通入CO2,先发生Ca(OH)2+CO2═CaCO3↓+H2O,生成沉淀,再发生CO2+NaOH═NaHCO3,沉淀的量不变,最后发生反应:CaCO3↓+H2O+CO2═Ca(HCO3)2,沉淀溶解,且生成沉淀和沉淀溶解消耗的CO2相等,图象与反应不符合,故B错误;
C.醋酸是弱酸,导电能力不大,加入氨水后,离子方程式:NH3·H2O+CH3COOH═NH4++H2O+CH3COO-,生成醋酸铵是强电解质,导电能力增强,导电性变化大,至过量时,氨水溶液的体积占主导,离子浓度变小,导电能力降低,故C错误;
D.一水合氨不会溶解氢氧化铝,氯化铝与氨水反应的离子方程式为:Al3++3NH3·H2O═Al(OH)3↓+3NH4+,沉淀不溶解,故D错误;
故选:A。

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案【题目】下列是某同学对相应反应的离子方程式所作的评价,其中评价合理的是()
编号 | 化学反应 | 离子方程式 | 评价 |
| 碳酸钙与醋酸反应 |
| 错误,碳酸钙是弱电解质,不应写成离子形式 |
| 向 |
| 错误,碱过量,应生成 |
|
|
| 正确 |
| 等物质的量的 |
| 正确 |
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()