【题目】氯化亚砜(SOCl2)在科研和工业上应用比较广泛。回答下列问题:
I.工业上利用尾气SO2与SCl2、Cl2反应合成氯化亚砜。发生如下反应:
①Cl2(g)+SO2(g)![]() SO2Cl2(g) △H =-471.7kJmol-1
SO2Cl2(g) △H =-471.7kJmol-1
②SO2Cl2(g)+SCl2(g)![]() 2SOCl2(g) △H=-5.6kJmol-1
2SOCl2(g) △H=-5.6kJmol-1
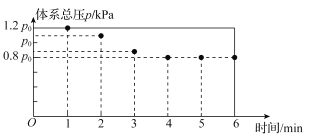
567K时,在10L密闭容器中,充入一定量的Cl2、SO2和SCl2,测得初始压强为P0反应过程中容器内总压强(P)随时间(t)变化(反应达到平衡时的温度与起始温度相同)如图所示,起始各组分及达平衡时SO2Cl2(g)的物质的量如表。
各组分 | Cl2 | SO2(g) | SCl2(g) | SO2Cl2(g) | SOCl2(g) |
起始/mol | 0.5 | 0.5 | 0.5 | 0 | 0 |
平衡/mol | 0.2 |
(1)图中数据显示0~l min体系压强增大的原因是____。
(2)反应①、②达到平衡时,SCl2的转化率为__。
(3)pK=-lgK,567K时,上述反应②的pK=___(结果保留两位有效数字,已知lg2=0.30)。
(4)567K下,若压缩容器体积为5L,则平衡时c(SO2)__(填“大于” “小于”或“等于”)上述反应平衡时的c(SO2)。
II.氯化亚砜常用于合成正丁酰氯。向连有尾气吸收装置的容器中按照物质的量1:1.5投料比加入正丁酸和氯化亚砜,反应为CH3CH2CH2COOH+SOCl2![]() CH3CH2CH2COCl+SO2↑+HCl↑。实验测得温度和时间对反应的影响如表:
CH3CH2CH2COCl+SO2↑+HCl↑。实验测得温度和时间对反应的影响如表:
序号 | 实验方法 | 收率/% |
1 | 25℃,反应6h | 73.60 |
2 | 25℃,反应8h | 74.60 |
3 | 75℃,反应2h | 75.00 |
4 | 75℃,反应3h | 76.00 |
5 | 先25℃,反应1h;后75℃,反应0~1h | 81.10 |
6 | 先25℃,反应1h;后75℃,反应0~1h | 87.10 |
(5)若开始在较高温度下反应,则会放出大量气体。通过分析上表数据,选择合理实验方法的序号为___。说明你选用实验方法的理由:____。