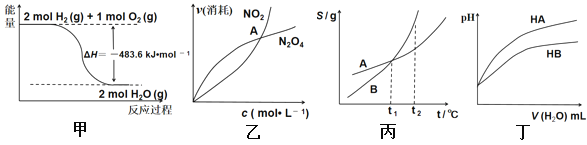
【题目】部分中学化学常见元素原子结构及性质如表所示
元素 | 结构及性质 |
A | A在第三周期中简单离子半径最小 |
B | B原子最外层电子数是内层电子数的 |
C | 使用最广泛的金属元素C能形成两种氯化物,其相对分子质量之差为35.5 |
D | D与B同主族,且通常状况下D没有正化合价 |
E | E在周期表中位于IA族,有人认为将其排在VIIA族也有一定道理 |
F | F与B同周期,其最高价氧化物的水化物与A或B的最高价氧化物的水化物均能反应 |
(1)C元素在周期表中的位置_____________;E形成的一种简单离子能支持“将E排在VIIA族”这一观点,该离子的结构示意图为_______________________。
(2)E与D可以按原子个数比2:1、1:1形成两种化合物X、Y,区别X、Y这两种物质的实验方法为________________________________。
E与B形成的一种化合物Z与X、Y中的一种电子总数相同且能发生化学反应,写出该反应的化学方程式__________________________(用相应化学式表示)
(3)请画出化合物F2B2的电子式__________,该化合物中含有的化学键类型是_______。
(4)将A、C的单质用导线连接后插入F的最高价氧化物的水化物溶液中可形成原电池,该原电池中阴离子移向_________(填“A”或“C”),写出该原电池总反应的离子方程式____________________。
【题目】资源化利用CO具有重要意义。
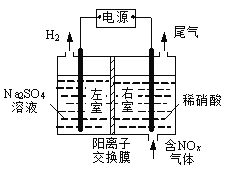
(1)CO可设计成燃料电池,熔融Li2CO3和Na2CO3的混合物作为燃料电池的电解质,氧化剂是含CO2的O2,工作时正极反应为__________________,以该燃料电池为电源处理含氮氧化物废气,可回收硝酸,同时制得副产物氢气,装置如图所示(电极均为石墨电极)。该装置中应选用_______(填“阴”或“阳”)离子交换膜,写出电解时NO2发生反应的电极反应式:___________________。
(2)CO是高炉炼铁的重要还原剂,炼铁时发生的主要反应有:
反应 | △H(kJ/mol) |
I. Fe2O3(s)+3C(s) | +489 |
II. Fe2O3(s)+3CO(g) | -27 |
III. C(s)+CO2(g) | X |
试计算,试计算,X=_________。
T1℃时,向某恒温密闭容器中加入一定量的Fe2O3和C,发生反应I,反应达到平衡后,在t1时刻改变某条件,v(逆)随时间(t)的变化关系如图所示,则t1时刻改变的条件可能是_____________________。
a.保持温度、体积不变,使用催化剂 b.保持体积不变,升高温度
c.保持温度不变,压缩容器体积 d.保持温度、体积不变,充入CO
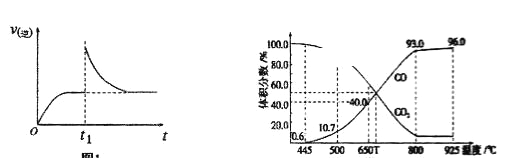
(3)在一定温度下,向某体积可变的恒压(P总)密闭容器中加入1mol CO2与足量的碳发生反应III,平衡时体系中气体体积分数与温度的关系如图所示。
①650℃时,反应达平衡后CO2的转化率为____________。
②T℃时,该反应达到平衡时下列说法不正确的是__________________。
a.气体密度保持不变
b.2v正(CO2)=v正(CO)
c.若保持其它条件不变再充入等体积的CO2和CO,平衡向逆反应方向移动
d.若保持其它条件不变再充入惰性气体,v正、v逆均减小,平衡不移动
e.若其它条件不变将容器体积压缩至一半并维持体积不变,再次达平衡时压强小于原平衡的2倍
③根据图中数据,计算反应III在T℃时用平衡分压代替平衡浓度表示的化学平衡常数KP=___________(设总压强为P总,用含P总的代数式表示)
【题目】钴被誉为战略物资,有出色的性能和广泛的应用.以水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、A12O3、MnO等)制取钴产品的工艺流程如下:

已知:
①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、A13+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH如表所示:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Mn(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
回答下列问题:
(1)写出浸出过程、Co2O3发生反应的离子方程式:_________________________。
(2)写出NaC1O3发生反应的主要离子方程式:______________________________;
(3)“加Na2CO3调pH至5.2”,过滤所得到的沉淀成分为____________________________。
(4)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是_________________;萃取剂使用的最佳pH范围是__________(填代号)。
A.1.0~1.5 B.2.0~2.5 C.3.0~3.5 D.4.0~4.5

(5)“沉钴”时生成CoCO3的离子方程式为__________________________________。
(6)在空气中焙烧CoCO3生成CoxOy和CO2,测得充分煅烧后固体质量为4.82g,CO2的体积为1.344L(标准状况),则CoxOy的化学式为___________________。
【题目】为探究FeCl3溶液中的离子平衡和离子反应,某小组同学进行了如下实验。
(1)配制50 mL 1.0 mol·L1的FeCl3溶液,测其pH约为0.7,即c(H+) = 0.2 mol·L1。
① 用化学用语解释FeCl3溶液呈酸性的原因: 。
② 下列实验方案中,能使FeCl3溶液pH升高的是 (填字母序号)。
a. 加水稀释 b. 加入FeCl3固体
c. 滴加浓KSCN溶液 d. 加入NaHCO3固体
(2)小组同学利用上述FeCl3溶液探究其与足量锌粉的反应。实验操作及现象如下:
操作 | 现象 |
向反应瓶中加入6.5 g锌粉,然后加入50 mL 1.0 mol·L1的FeCl3溶液,搅拌 | 溶液温度迅速上升,稍后出现红褐色沉淀,同时出现少量气泡;反应一段时间后静置,上层溶液为浅绿色,反应瓶底部有黑色固体 |
收集检验反应过程中产生的气体 | 集气管口靠近火焰,有爆鸣声 |
已知:Zn的性质与Al相似,能发生反应:Zn + 2NaOH = Na2ZnO2 + H2 ↑
① 结合实验现象和平衡移动原理解释出现红褐色沉淀的原因: 。
② 用离子方程式解释反应后溶液为浅绿色的原因: 。
③ 分离出黑色固体,经下列实验证实了其中含有的主要物质。
i. 黑色固体可以被磁铁吸引;
ii. 向黑色固体中加入足量的NaOH溶液,产生气泡;
iii. 将ii中剩余固体用蒸馏水洗涤后,加入稀盐酸,产生大量气泡;
iv. 向iii反应后的溶液中滴加KSCN溶液,无变化。
a. 黑色固体中一定含有的物质是 。
b. 小组同学认为上述实验无法确定黑色固体中是否含有Fe3O4,理由是 。
(3)为进一步探究上述1.0 mol·L1 FeCl3溶液中Fe3+和H+氧化性的相对强弱,继续实验并观察到反应开始时现象如下:
操作 | 现象 |
将5 mL 1.0 mol·L1的FeCl3溶液与0.65 g锌粉混合 | 溶液温度迅速上升,开始时几乎没有气泡 |
将 与0.65 g锌粉混合 | 溶液中立即产生大量气泡 |
小组同学得出结论:在1.0 mol·L1 FeCl3溶液中,Fe3+的氧化性比H+更强。