【题目】PCl3是磷的常见氯化物,可用于半导体生产的外延、扩散工序。有关物质的部分性质如下:
熔点/℃ | 沸点/℃ | 密度/ g·mL-1 | 其他 | |
黄磷 | 44.1 | 280.5 | 1.82 | 2P+3Cl2(少量) |
PCl3 | -112 | 75.5 | 1.574 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
(一)制备
如图是实验室制备PCl3的装置(部分仪器已省略)。
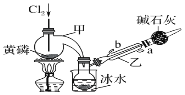
(1)仪器乙的名称是________;其中,与自来水进水管连接的接口编号是________。(填“a”或“b”)
(2)实验室制备Cl2的离子方程式___________________________。实验过程中,为减少PCl5的生成,应控制____________。
(3)碱石灰的作用:一是防止空气中的水蒸气进入而使PCl3水解,影响产品的纯度;二是_________。
(4)向仪器甲中通入干燥Cl2之前,应先通入一段时间CO2排尽装置中的空气,其目的是________。
(二)分析
测定产品中PCl3纯度的方法如下:迅速称取4.100 g产品,水解完全后配成500 mL溶液,取出25.00 mL加入过量的0.100 0 mol·L-1 20.00 mL碘溶液,充分反应后再用0.100 0 mol·L-1 Na2S2O3溶液滴定过量的碘,终点时消耗12.00 mL Na2S2O3溶液。
已知:H3PO3+H2O+I2===H3PO4+2HI;I2+2Na2S2O3===2NaI+Na2S4O6;假设测定过程中没有其他反应。
(5)根据上述数据,该产品中PCl3(相对分子质量为137.5)的质量分数为________。若滴定终点时俯视读数,则PCl3的质量分数________(填“偏大”“偏小”或“无影响”)。
(三)探究
(6)设计实验证明PCl3具有还原性:_____________________________________。(限选试剂有:蒸馏水、稀盐酸、碘水、淀粉)
【题目】下列图示装置和对应实验原理的描述均正确的是
A | B | C | D |
|
|
|
|
根据温度计读数的变化测定浓硫酸和NaOH溶液反应的反应热 | 加热固体NaHCO3制备少量的Na2CO3 | 验证牺牲阳极的阴极保护法,可证明铁被保护 | 根据小试管中液面的变化可判断铁钉发生了析氢腐蚀 |
A. AB. BC. CD. D
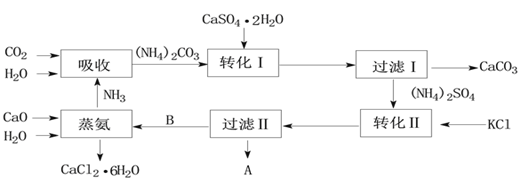
【题目】下图是某工业生产过程。
溶解度表:
温度℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 | 100 |
氯化铵 | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 55.2 | 65.6 | 71.3 | 77.3 |
硫酸铵 | 70.6 | 73 | 75.4 | 78 | 81 | 88 | 95 | 98 | 103 |
硫酸钾 | 7.4 | 9.3 | 11.1 | 13 | 14.8 | 18.2 | 21.4 | 22.9 | 24.1 |
氯化钾 | 28 | 31.2 | 34.2 | 37.2 | 40.1 | 45.8 | 51.3 | 53.9 | 56.3 |
(1)本工业生产过程的目标产品是____________________________________。(写化学式)
(2)过滤Ⅰ操作所得固体中,除CaCO3外还有一种物质,该固体的用途有_________(试举一例)。
(3)根据溶解度表转化Ⅱ适宜的温度是________
A、0~10℃ B、20~30℃ C、40~60℃ D、90~100℃
过滤Ⅱ操作所得滤渣是__________。
(4)我国著名的化学家也利用了转化Ⅱ的反应原理制备了一种重要的碱,该制备的化学反应方程式为:___________________________________________________
(5)氯化钙结晶水合物(CaCl2·6H2O)进行脱水处理可制得常用的干燥剂,根据下图选择最佳脱水的方法是__________
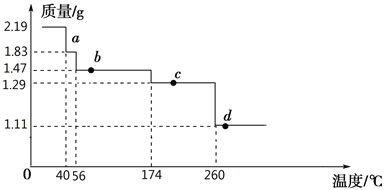
A、氯化氢气流中加热到174℃ B、直接加热至174℃
C、直接加热至260℃ D、氯化氢气流中加热到260℃
(6)上述工业流程实现了绿色化学的理念,其中__________________(填化学式)实现了循环利用,副产品_________________________(填化学式)可转化为原料,整个流程基本实现了污染物零排放。