题目内容
【题目】3H2O2 + 2H2CrO4 =2 Cr(OH)3 + 3O2 ↑+ 2H2O
(1)其中Cr被___________,H2O2作____________剂。
(2)_____________是氧化产物,_______________发生还原反应。
(3)反应转移了0.3mol电子,则产生的气体在标准状态下体积约为__________。
(4)用单线桥标明电子转移的方向和数目。_______
【答案】还原 还原 O2 H2CrO4 3.36L ![]()
【解析】
反应3H2O2+2H2CrO4=2Cr(OH)3+3O2+2H2O中,H2CrO4中Cr化合价从+6→+3,得电子,H2O2中O化合价从-1→0,失电子,结合氧化还原反应的规律分析解答。
(1)3H2O2+2H2CrO4═2Cr(OH)3+3O2↑+2H2O,反应中铬元素化合价从+6价变化为+3价,元素化合价降低,H2CrO4做氧化剂,被还原,发生还原反应;氧元素化合价-1价变化为0价,元素化合价升高,H2O2做还原剂,被氧化,发生氧化反应;故答案为:还原;还原;
(2)3H2O2+2H2CrO4═2Cr(OH)3+3O2↑+2H2O,反应中氧元素化合价-1价变化为0价,元素化合价升高,被氧化,氧化产物为O2;铬元素化合价从+6价变化为+3价,元素化合价降低,H2CrO4做氧化剂,被还原,发生还原反应,故答案为:O2;H2CrO4;
(3)3H2O2+2H2CrO4═2Cr(OH)3+3O2↑+2H2O反应中铬元素化合价从+6价变化为+3价;氧元素化合价-1价变化为0价,依据元素化合价变化,生成3mol氧气转移电子6mol,当反应转移0.3mol电子,则产生的氧气为0.15mol,在标准状态下的体积约为0.15mol×22.4L/mol=3.36L,故答案为:3.36L;
(4)Cr元素化合价从+6→+3,得电子,O元素化合价从-1→0,失电子,因此箭头由O指向Cr,转移的电子总数为:2×(6-3)=6,用单线桥法表示反应中电子转移的方向和数目为![]() ,故答案为:
,故答案为:![]() 。
。

【题目】如表中评价合理的是( )
选项 | 化学反应及其离子方程式 | 评价 |
A | NaHSO4溶液与Ba(OH)2溶液反应至SO42-沉淀完全:2H++ SO42-+Ba2++2OH==BaSO4↓+2H2O | 正确 |
B | 向碳酸镁浊液中加入足量稀盐酸:CO32- +2H+ | 错误,碳酸镁不应写成离子形式 |
C | 向沸水中滴加饱和的氯化铁溶液至液体变为红褐色:Fe3++3H2O==Fe(OH)3↓+3H+ | 正确 |
D | 碳酸氢钠与足量澄清石灰水反应:2HCO3-+Ca2++2OH-==CaCO3↓+CO32-+2H2O | 正确 |
A.AB.BC.CD.D
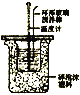
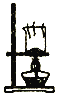
【题目】下列图示装置和对应实验原理的描述均正确的是
A | B | C | D |
|
|
|
|
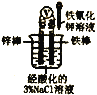
根据温度计读数的变化测定浓硫酸和NaOH溶液反应的反应热 | 加热固体NaHCO3制备少量的Na2CO3 | 验证牺牲阳极的阴极保护法,可证明铁被保护 | 根据小试管中液面的变化可判断铁钉发生了析氢腐蚀 |
A. AB. BC. CD. D