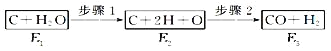【题目】用下图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是
选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A. | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B. | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
C. | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
D. | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
【题目】现使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL)
Ⅰ.实验步骤
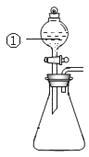
(1)配制100mL待测白醋溶液:用______![]() 填仪器名称
填仪器名称![]() 量取10.00mL市售白醋,在烧杯中用水稀释后转移到______
量取10.00mL市售白醋,在烧杯中用水稀释后转移到______![]() 填仪器容量、名称
填仪器容量、名称![]() 中定容,摇匀即得待测白醋溶液.
中定容,摇匀即得待测白醋溶液.
(2)用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴_____作指示剂.
(3)读取盛装0.1000mol/LNaOH溶液的碱式滴定管的初始读数:如果液面位置如图所示,则此时的读数为______mL.
![]()
(4)滴定:当________________________________________时,停止滴定,并记录NaOH溶液的终读数,重复滴定3次。
Ⅱ.实验记录
滴定次数实验数据(mL) | 1 | 2 | 3 | 4 |
V(样品) |
|
|
|
|
V(NaOH)(消耗) |
|
|
|
|
Ⅲ.数据处理与讨论
(5)甲同学在处理数据时计算得:平均消耗的NaOH溶液的体积:V=![]() =15.24mL指出他的计算的不合理之处:_________________________________________________。
=15.24mL指出他的计算的不合理之处:_________________________________________________。
选取正确数据,可得![]() 市售白醋
市售白醋![]() ____mol/L;市售白醋总酸量
____mol/L;市售白醋总酸量![]() ____g/100mL。
____g/100mL。
(6)乙同学仔细研究了该品牌白醋的标签,发现其中还含有苯甲酸钠作为食品添加剂,他想用资料法验证醋酸与苯甲酸钠不会发生离子互换反应,需查找在一定温度下的醋酸与苯甲酸的________(填标号).
A.pHB.电离度C.电离常数D.溶解度
(7)在本实验的滴定过程中,下列操作会使实验结果偏大的是______(填标号).
A.碱式滴定管在用蒸馏水洗净后,未用标准NaOH溶液润洗
B.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
C.锥形瓶中加入待测白醋溶液后,再加少量水
D.锥形瓶在滴定时剧烈摇动,有少量液体溅出.
【题目】Ⅰ.常温下有浓度均为0.1 mol/L的四种溶液:①Na2CO3 ②NaHCO3 ③HCl ④NH3·H2O
(1)这四种溶液中水的电离程度由大到小的顺序是___________________(用序号填写)。
(2)等体积混合③和④的溶液中离子浓度的大小顺序是:__________________________。
(3)②溶液中存在的质子守恒关系:c(OH-)=___________________________。
(4)向④中加入少量氯化铵固体,溶液中c(H+)______(填“增大”、“减小”或“不变”)
(5)取10mL溶液③,加水稀释到100mL,则该溶液中由水电离出的c(H+)约为________。
Ⅱ.普通泡沫灭火器内的玻璃筒里盛有Al2(SO4)3溶液,铁筒中盛有NaHCO3溶液,当意外失火时,打开泡沫灭火器使药液混合,喷出大量的白色泡沫,阻止火势蔓延,其相关的离子方程式为:______________________________________,不能把Al2(SO4)3溶液盛放在铁筒中的主要原因是______________________________________________________。
Ⅲ.某工厂的电镀污泥中含有铜、铁等金属化合物。为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:

沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 2.3 | 7.6 | 4.4 |
完全沉淀的pH | 3.2 | 9.7 | 6.4 |
(1)酸浸后加入H2O2的目的是___________________,调pH的最适宜范围为__________。
(2)调pH过程中加入的试剂最好是___________(填标号)。
A. NaOH B. CuO C.NH3·H2O D.HCl