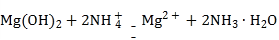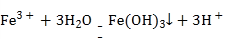题目内容
【题目】(1)如图是碳和水蒸气发生反应生成CO、H2的途径和三个状态的能量,该反应为吸热反应,比较E1、E2、E3的大小:_____。

(2)已知2mol氢气燃烧生成液态水时放出572kJ的热量,反应方程式是2H2(g)+O2(g)═2H2O(l)。请回答下列问题:
①该反应的生成物能量总和____(填“大于”、“小于”或“等于”)反应物能量总和。
②若2mol氢气完全燃烧生成水蒸气,则放出的热量____(填“大于”、“小于”或“等于”)572kJ。
(3)已知拆开1molN﹣N键、1molN﹣H键、1molN≡N键、O=O键需要的能量分别是3akJ、2.5akJ、8akJ、4akJ,完全燃烧1mol火箭燃料肼(N2H4)生成氮气和水蒸气放出能量为5akJ,则1molH2O(g)完全断键时共吸收____kJ的能量。
(4)已知化学反应A2(g)+B2(g)═2AB(g)的能量变化如图所示,反应物的总键能_____(填“大于”、“小于”或“等于”)生成物的总键能。

【答案】E2>E3>E1 小于 小于 4a 大于
【解析】
(1)化学反应的本质即是旧键的断裂和新键的形成过程,旧键断裂吸收能量,新键形成放出能量,这是化学反应中能量变化的主要原因,据此进行分析。
(2)①由反应热ΔH=生成物的总能量-反应物的总能量进行判断。
②同一物质状态由气→液→固变化时,会放热,反之,会吸热。据此进行分析。
(3)由反应热ΔH=反应物的键能总和-生成物的键能总和进行计算判断。
(4)分析题给能量变化图,根据放热反应中其反应物具有的总能量大于生成物具有的总能量,吸热反应中反应物具有的总能量小于生成物具有的总能量,进行判断。
(1)E1~E2的过程,为旧化学键断裂而吸收能量的过程,故E1<E2,E2~E3的过程,为新化学键形成而放出能量的过程,则:E2>E3,根据题给信息,反应为吸热反应,则有:E1<E3,故E1、E2、E3的大小关系为:E2>E3>E1,故答案为:E2>E3>E1;
(2)①反应放出热量,说明反应物具有的能量总和大于生成物具有的能量总和,故答案为:小于;
②因同一物质状态由气→液→固变化时,会放热,即同一物质气态时具有的能量高于该物质液态时所具有的能量,则2mol氢气燃烧生成液态水时放出572kJ的热量,若生成水蒸气,则放出的能量小于572kJ。答案为:小于;
(3)根据题意可知肼燃烧的热化学反应方程式为:N2H4+O2=2H2O+N2 ΔH=-5akJ/mol。根据反应热ΔH=反应物的总键能之和-生成物的总键能之和,设1molH-O键断裂时需要能量为x,有:![]() ,解得:
,解得:![]() ,则1mol H2O(g)完全断键时吸收的能量为:4akJ。故答案为:4a。
,则1mol H2O(g)完全断键时吸收的能量为:4akJ。故答案为:4a。
(4)分析题给能量变化图可知,反应物所具有的能量低,生成物具有的能量高,则总反应为吸热反应,则反应物的总键能大于生成物的总键能,答案为:大于。
物质 | CO2 (C=O) | CH4 (C-H) | P4 (P-P) | SiO2 (Si-O) | 石墨 (C-C) | 金刚石 (C-C) | S8 (S-S) | Si (Si-Si) |
键数 | 2 | 4 | 6 | 4 | 1.5 | 2 | 8 | 2 |

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案【题目】下列离子方程式能用来解释相应实验现象的是
实验现象 | 离子方程式 | |
A | 向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解 |
|
B | 向沸水中滴加饱和氯化铁溶液得到红褐色液体 |
|
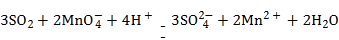
C | 二氧化硫使酸性高锰酸钾溶液褪色 |
|
D | 氧化亚铁溶于稀硝酸 |
|
A. AB. BC. CD. D