【题目】为检验溶液中是否含有Cl-,某同学采用向溶液中先加HNO3,再加AgNO3,溶液的实验方案,若有白色沉淀生成,则证明有Cl-。对此结论,有人提出了质疑,设计了如下探究性实验。
实验一:向Na2SO4溶液中滴加AgNO3溶液
编号 | Na2SO4溶液 | AgNO3溶液 | 现象 | ||
体积/mL | 浓度/(mol·L-1) | 体积/滴 | 浓度/(mol·L-1) | ||
① | 1 | l | 3 | 2 | 出现大量白色沉淀 |
② | 1 | 1 | 3 | 0.5 | 出现少量白色沉淀 |
③ | 1 | 1 | 3 | 0.1 | 有些许浑浊 |
④ | 1 | 1 | 3 | 0.0l | 无明显变化 |
(1)实验一中产生沉淀的离子方程式为______。
(2)学生设计了如下表格,对实验一内容进行理论计算,请帮他完成表格。(表中不要留空格)。
[25℃时Ksp(Ag2SO4)=1.2×10-5,Ksp(AgCl)=1.8×10-10]
编号 | AgNO3浓度/(mol·L-1) | 稀释后Ag+浓度/(mol·L-1) | 混合液中SO42-的最小理论检出浓度/(mol·L-1) |
① | 2 | 0.2 | 0.0003 |
② | 0.5 | _______ | 0.0048 |
③ | 0.1 | 0.0l | 0.12 |
④ | _______ | 0.001 | _________ |
若向lmL某溶液中加入3滴0.1mol/LAgNO3溶液,分析上面数据,判断下列说法正确的是__ (填字母序号)。
A.混合液中c(SO42-)=0.1mol/L时不会产生Ag2SO4沉淀
B.混合液中c(SO42-)=1mol/L时不会产生Ag2SO4沉淀
C.无论SO42-浓度大小都会产生Ag2SO4沉淀
D.若使用0.01 mol/LAgNO3溶液,可基本排除SO42-对Cl-检验构成的干扰
(3)将实验一中编号③中的理论计算结果与现象对照,发现理论上大部分Ag+应该形成沉淀,这与“有些许浑浊”的现象相矛盾。为探究真相,在实验一的基础上继续设计了以下实验。
实验二:
编号 | AgNO3溶液 浓度/(mol·L-1) | 现象 | 向沉淀中滴加硝酸后的现象 |
① | 2 | 出现大量白色沉淀 | 滴加稀硝酸,沉淀大量溶解;改加浓硝酸,沉淀较快消失 |
② | 0.5 | 出现少量白色沉淀 | 滴加稀硝酸,沉淀基本消失 |
对于Ag2SO4溶于硝酸的原因提出了如下假设,请完成假设一。(已知:H2SO4=H++HSO4-、HSO4-![]() H++SO42-;假设二可能的原因是NO3-与Ag+形成配位化合物)
H++SO42-;假设二可能的原因是NO3-与Ag+形成配位化合物)
假设一:_____________。
假设二:NO3-对Ag2SO4溶解起作用。
(4)从下列限选试剂中选择适当试剂并设计实验方案,分别验证假设一和假设二是否成立。请写出实验步骤和结论。(限选试剂:Ag2SO4固体、浓HNO3、NaNO3饱和溶液、CaSO4固体)
________________
(5)通过(4)的实验,若证实假设一成立,请用平衡理论解释Ag2SO4溶解的原因_________
【题目】镧系为元素周期表中第ⅢB族、原子序数为57~71的元素。
(1)镝(Dy)的基态原子电子排布式为[Xe]4f106s2,画出镝(Dy)原子外围电子排布图:___________。
(2)高温超导材料镧钡铜氧化物中含有Cu3+,基态时Cu3+ 的电子排布式为________________。
(3)观察下面四种镧系元素的电离能数据,判断最有可能显示+3 价的元素是___________(填元素名称)。几种镧系元素的电离能(单位:kJ mol-1)
元素 | I1 | I2 | I3 | I4 |
Yb(镱) | 604 | 1217 | 4494 | 5014 |
Lu(镥) | 532 | 1390 | 4111 | 4987 |
La(镧) | 538 | 1067 | 1850 | 5419 |
Ce(铈) | 527 | 1047 | 1949 | 3547 |
(4)元素铈(Ce)可以形成配合物(NH4)2[Ce(NO3)6]。
①组成配合物的四种元素,电负性由大到小的顺序为________________(用元素符号表示)。
②写出氮的最简单气态氢化物水溶液中存在的氢键:__________________(任写一种)。
③元素Al 也有类似成键情况,气态氯化铝分子表示为(AlCl3)2,分子中Al 原子杂化方式为_____________,分子中所含化学键类型有______________(填字母)。
a.离子键 b.极性键 C.非极性键 d.配位键
(5)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中镨原子位于面心和顶点,则PrO2(二氧化镨)的晶胞中有________个氧原子;已知晶胞参数为a pm,密度为ρ g· cm-3,NA=_____________ (用含a、ρ的代数式表示)。
【题目】中科院一项最新成果实现了甲烷高效生产乙烯,甲烷在催化作用下脱氢,在气相中经自由基偶联反应生成乙烯,其反应如下:2CH4(g)![]() C2H4(g) +2H2(g) △H >0
C2H4(g) +2H2(g) △H >0
化学键 | H—H | C—H | C = C | C—C |
E(kJ / mol) | a | b | c | d |
(1)已知相关化学键的键能如表,甲烷制备乙烯反应的△H =______(用含a.b.c.d的代数式表示)。
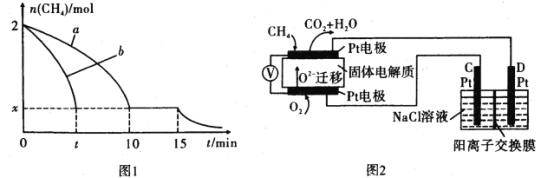
(2)T1温度时,向1L的恒容反应器中充入2 molCH4,仅发生上述反应,反应过程中0~15 min CH4的物质的量随时间变化如图1,测得10-15 min时H2的浓度为1.6molL-1
①0~10min内CH4表示的反应速率为____mol/(Lmin) o
②若图1中曲线a、曲线b分别表示在温度T1时,使用质量相同但表面积不同的催化剂时,达到平衡过程中n (CH4)的变化曲线,其中表示催化剂表面积较大的曲线是____(填“a”或 “b”)。
③15 min时,若改变外界反应条件,导致n( CH4)发生图中所示变化,则改变的条件可能是________(任答一条即可)。
(3)实验测得:v正=K正c2(CH4),v逆=K逆c(C2H4)c2(H2),其中K正、K逆为速率常数仅与温度有关,T1温度时k正与K逆的比值为____(填数值)。若将温度由T1升高到T2,则反应速率增大的倍数V正____V逆(选填“>”、“<”或“=”);判断的理由是__________
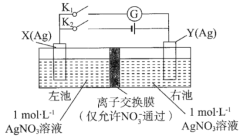
(4)科研人员设计了甲烷燃料电池并用于电解。如图2所示,电解质是掺杂了Y2O3与ZrO2的固体,可在高温下传导O2-
①C极的Pt为_____极(选填“阳”或“阴” )。
②该电池工作时负极反应方程式为_______。
③用该电池电解饱和食盐水,一段时间后收集到标况下气体总体积为112 mL,则电解后所得溶液在25℃时pH=_____(假设电解前后NaCl溶液的体积均为500 mL)。