【题目】现有六种元素,其中 A、B、C、D 为短周期主族元素,E、F 为第四周期元素,它们的原子序数依次增大。
A 元素原子的核外 p 电子数比 s 电子数少 3 |
B 元素形成的物质种类繁多,其形成的一种固体单质工业上常用作切割工具 |
C 元素基态原子 p 轨道有 3 个未成对电子 |
D 原子核外所有 p 轨道全满或半满 |
E 在该周期中未成对电子数最多 |
F 能形成红色(或砖红色)和黑色的两种氧化物 |
请根据以上相关信息,回答问题:
(1)A 的卤化物在工业中有重要作用,A 的四种卤化物的沸点如下表所示:
卤化物 | AF3 | ACl3 | ABr3 | AI3 |
沸点/K | 172 | 285 | 364 | 483 |
①四种卤化物沸点依次升高的原因是_________________。
② ACl3、LiAH4 中A 原子的杂化轨道类型依次为______、_______;与 A3N3H6 互为等电子体的分子的结构简式为___________。
③用AF3分子结构解释反应 AF3(g)+NH4F(s)=NH4AF4(s)能够发生的原因:_________________。
(2)某同学根据上述信息,推断
①B基态原子的核外最子排布为 ,该同学所画的电子排布图违背了________。
,该同学所画的电子排布图违背了________。
② 已知元素 B 的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是________。
A.分子中含有分子间氢键 B.属于含有极性键的非极性分子
C.只含有4个sp-s的σ键和1个p-p的π键 D.该氢化物分子中 B 原子采用 sp2 杂化
(3)D 基态原子中能量最高的电子,其电子云在空间有______个方向,原子轨道呈______形。
(4)写出 E 原子的电子排布式______________。
(5)请写出 F 元素外围电子排布式_________。向 FSO4溶液中滴加入C元素氢化物的水溶液,先生成蓝色沉淀,后沉淀逐渐溶解,得到深蓝色透明溶液,请写出沉淀溶解的离子方程式__________。
【题目】图用分类法表示了一些物质或概念之间的从属或包含关系,不正确的是( )
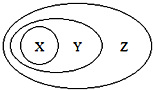
X | Y | Z | |
A | NaAlO2 | 盐 | 纯净物 |
B | 胶体 | 分散系 | 混合物 |
C | Al2O3 | 两性氧化物 | 氧化物 |
D | 单质参与反应 | 置换反应 | 氧化还原反应 |
A. A B. B C. C D. D


