0 175829 175837 175843 175847 175853 175855 175859 175865 175867 175873 175879 175883 175885 175889 175895 175897 175903 175907 175909 175913 175915 175919 175921 175923 175924 175925 175927 175928 175929 175931 175933 175937 175939 175943 175945 175949 175955 175957 175963 175967 175969 175973 175979 175985 175987 175993 175997 175999 176005 176009 176015 176023 203614
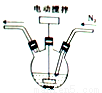
 之间配料,加入三颈烧瓶中(如图),然后加入适量水,并向装置中持续通入N2,在40-60℃下搅拌反应30-50min,待反应完成检验出反应液中不含碘单质后,过滤即制得碘化亚铁溶液。
之间配料,加入三颈烧瓶中(如图),然后加入适量水,并向装置中持续通入N2,在40-60℃下搅拌反应30-50min,待反应完成检验出反应液中不含碘单质后,过滤即制得碘化亚铁溶液。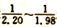 ,在80-100℃下,反应30-50 min,反应生成碘化钠及硫酸亚铁等。该反应的化学方程式为____________。
,在80-100℃下,反应30-50 min,反应生成碘化钠及硫酸亚铁等。该反应的化学方程式为____________。 2SO2(g)△H<0,下列事实能表明该反应达到平衡的是___________。
2SO2(g)△H<0,下列事实能表明该反应达到平衡的是___________。



 为起始原料(无机试剂任选)制备
为起始原料(无机试剂任选)制备 的合成路线_________________。
的合成路线_________________。 B. 氢氧根离子的电子式:
B. 氢氧根离子的电子式: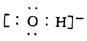
 D. 中子数为146,质子数为92的铀(U)原子
D. 中子数为146,质子数为92的铀(U)原子