将一定量的H2O(g)和CO(g)分别通入到一体积为2 L的恒容密闭容器中进行反应:H2O(g)+CO(g)CO2(g)+H2(g),得到以下三组数据,据此回答下列问题:
实验组 | 温度 | 起始量 | 平衡量 | 达到平衡所需时间 | ||
H2O | CO | H2 | CO | |||
1 | 650℃ | 1 mol | 2 mol | 0.8 mol | 1.2 mol | 5 min |
2 | 900℃ | 0.5 mol | 1 mol | 0.2 mol | 0.8 mol | 3 min |
3 | 900℃ | a | b | c | d | t |
(1)①由以上数据,实验1中以v(CO2)表示反应速率为_______,以α(CO)表示转化率为_____。
②该反应在650℃时平衡常数数值为_________,该反应的逆反应为_________ (填“吸”或“放”)热反应。
③若实验3和实验2中CO的百分含量相同,且t<3 min,则a、b应满足的关系是_______。
(2)下图1、2表示上述反应在时刻t1达到平衡,在时刻t2因改变某个条件而发生变化的情况:
①图1中时刻t2发生改变的条件可能是____________(写一条即可,下同)。
②图2中时刻t2发生改变的条件可能是______________________________________。

(3)在850 ℃时,其平衡常数K=1,850 ℃时在该容器中同时充入1.0 mol CO、3.0 mol H2O、1.0 mol CO2、5.0 mol H2,此时反应向________(填“正反应”或“逆反应”)方向进行,平衡时CO2的物质的量为__________。
某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选用甲基橙作指示剂。请填写下列空白:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,判断滴定终点的现象是__________________。
(2)下列操作中可能使所测NaOH溶液的浓度偏低的是______。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,所用盐酸溶液的体积为________mL。

(4)某学生根据3次实验分别记录有关数据如下表:
滴定次数 | 待测NaOH溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.31 | 26.31 |
第二次 | 25.00 | 1.56 | a | 28.74 |
第三次 | 25.00 | 0.22 | 26.51 | b |
表格中a的数值为_________, b的数值为_________。
依据上表数据列式计算该NaOH溶液的物质的量浓度为________________。
工业上制取CuCl2的生产流程如下:

请结合下表数据,回答下列问题:
物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
⑴ 溶液A中加入NaClO的目的是 ;
此反应离子方程式为 ;
⑵ 在溶液B中加入CuO的作用是 ;
⑶ 操作a的目的是 ;
⑷ 在Cu(OH)2加入盐酸使Cu(OH)2转变为CuCl2。采用多量盐酸和低温蒸干的目的是 。


 )=2c(Cl-)
)=2c(Cl-) Ba2+(aq)+SO
Ba2+(aq)+SO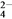 (aq)的平衡常数Ksp=c(Ba2+)·c(SO
(aq)的平衡常数Ksp=c(Ba2+)·c(SO
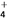 )大小顺序为________________。
)大小顺序为________________。 2SO3(g)达到平衡状态的是________。
2SO3(g)达到平衡状态的是________。