2. (1)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
(1)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
CO(g)+H2O(g)?CO2(g)+H2(g);△H<0 CO和H2O浓度变化如图,则0~4min的平均反应速率v(H2O)=0.03mol/(L•min);
(2)该反应的化学平衡常数表达式K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$.
T℃时物质浓度(mol/L)的变化
(3)T℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表.表中3min~4min 时间段之间反应处于平衡状态.
 (1)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
(1)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H<0 CO和H2O浓度变化如图,则0~4min的平均反应速率v(H2O)=0.03mol/(L•min);
(2)该反应的化学平衡常数表达式K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$.
T℃时物质浓度(mol/L)的变化
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
1. 工业制氢气的一个重要反应是:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0
工业制氢气的一个重要反应是:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0
现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
①对于反应CO(g)+H2O(g)?CO2(g)+H2(g),下列说法正确的是AD
A.当容器中CO的含量保持不变时,说明该反应达到平衡状态
B.若混合气体的密度不再改变,说明该反应已达化学平衡状态
C.实验I中,反应达到平衡后,再通入4molCO和2molH2O,平衡正向移动,H2的体积分数增大
D.若使用催化剂,会改变反应的途径,但反应的焓变不变
②实验I中,从反应开始到反应达到平衡时,CO的平均反应速率V(CO)=0.16mol/(L.min);
③实验II条件下反应的平衡常数K=0.33 (保留小数点后二位);H2O(g)的平衡转化率为50%.
④若在900℃时,实验II反应达到平衡后,向此容器中再加入1.5molCO、0.5mol H2O、0.2mol CO2、0.5mol H2,则平衡向正反应方向移动(填“正反应”、“逆反应”或“不移动”)
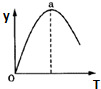
⑤若仅改变温度,纵坐标y随T变化如图所示,则纵坐标y表示的是AC.
A.CO2的百分含量 B.混合气体的平均相对分子质量C.CO的转化率 D.H2O的物质的量.
 工业制氢气的一个重要反应是:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0
工业制氢气的一个重要反应是:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡状态所需时间/min | ||
| CO | H2O | H2 | CO2 | |||
| Ⅰ | 650 | 4 | 2 | 1.6 | 1.6 | 5 |
| Ⅱ | 900 | 2 | 1 | 0.5 | 0.5 | 3 |
A.当容器中CO的含量保持不变时,说明该反应达到平衡状态
B.若混合气体的密度不再改变,说明该反应已达化学平衡状态
C.实验I中,反应达到平衡后,再通入4molCO和2molH2O,平衡正向移动,H2的体积分数增大
D.若使用催化剂,会改变反应的途径,但反应的焓变不变
②实验I中,从反应开始到反应达到平衡时,CO的平均反应速率V(CO)=0.16mol/(L.min);
③实验II条件下反应的平衡常数K=0.33 (保留小数点后二位);H2O(g)的平衡转化率为50%.
④若在900℃时,实验II反应达到平衡后,向此容器中再加入1.5molCO、0.5mol H2O、0.2mol CO2、0.5mol H2,则平衡向正反应方向移动(填“正反应”、“逆反应”或“不移动”)
⑤若仅改变温度,纵坐标y随T变化如图所示,则纵坐标y表示的是AC.
A.CO2的百分含量 B.混合气体的平均相对分子质量C.CO的转化率 D.H2O的物质的量.
8.将0.4mol/L NH4Cl溶液和0.2mol/L NaOH溶液等体积混合后,溶液中下列微粒的物质的量关系正确的是( )
| A. | c(NH4+)=c(Na+)=c(OH-)>c(NH3•H2O) | B. | c(NH4+)=c(Na+)>c(NH3•H2O)>c(OH-)>c(H+) | ||
| C. | c(NH4+)>c(Na+)>c(OH-)>c(NH3•H2O) | D. | c(NH4+)>c(Na+)>c(NH3•H2O)>c(OH-)>c(H+) |
4.将下列每组内的四种物质同时加入到水中,充分搅拌后,既有氧化还原反应发生,又有沉淀产生的一组是( )
| A. | Na2O2、NH4Cl、NaCl、Na2SO4 | B. | FeO、AlCl3、Na2SiO3、硝酸 | ||
| C. | KHCO3、Ca(OH)2、MgCl2、硫酸 | D. | NaCO3、BaCl2、K2S、盐酸 |
3.在含有FeCl3和BaCl2的强酸性溶液中通入足量的SO2有白色沉淀生,由此得出的结论是( )①白色沉淀是BaSO4②白色沉淀是BaSO3③白色沉淀是BaSO3和BaSO4的混合物④FeCl3被SO2还原为FeCl2.
| A. | ①③ | B. | ②④ | C. | ②③ | D. | ①④ |
2.已知a、b、d、e分别是Cu、Ag、Fe、Mg五种金属中的一种,实验测得其分别具有以下性质:①a能与稀硫酸反应放出气体;②b与d的硝酸盐反应,置换出单质d;③e的最高价阳离子遇KSCN溶液显血红色.由此判断a、b、d、e分别是( )
| A. | Fe、Cu、Ag、Mg | B. | Cu、Mg、Ag、Fe | C. | Mg、Cu、Ag、Fe | D. | Mg、Ag、Cu、Fe |
1.下列说法中错误的是( )
0 173831 173839 173845 173849 173855 173857 173861 173867 173869 173875 173881 173885 173887 173891 173897 173899 173905 173909 173911 173915 173917 173921 173923 173925 173926 173927 173929 173930 173931 173933 173935 173939 173941 173945 173947 173951 173957 173959 173965 173969 173971 173975 173981 173987 173989 173995 173999 174001 174007 174011 174017 174025 203614
| A. | 氢原子因获得一个电子能变成稳定结构,故也可将氢排在第ⅦA族 | |
| B. | 氢元素与其他元素形成化合物时,化合价只有+1价 | |
| C. | 氦气球与氢气球一样,因其密度比空气小,放飞后能腾空而起 | |
| D. | 锂与镁在周期表中位于对角线位置.可推得Li0H为中强碱 |
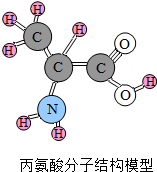 蛋白质是人类重要的营养物质,它是由多种氨基酸分子构成的化合物,丙氨酸是其中的一种,如图为丙氨酸的分子结构:
蛋白质是人类重要的营养物质,它是由多种氨基酸分子构成的化合物,丙氨酸是其中的一种,如图为丙氨酸的分子结构: