题目内容
1. 工业制氢气的一个重要反应是:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0
工业制氢气的一个重要反应是:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡状态所需时间/min | ||
| CO | H2O | H2 | CO2 | |||
| Ⅰ | 650 | 4 | 2 | 1.6 | 1.6 | 5 |
| Ⅱ | 900 | 2 | 1 | 0.5 | 0.5 | 3 |
A.当容器中CO的含量保持不变时,说明该反应达到平衡状态
B.若混合气体的密度不再改变,说明该反应已达化学平衡状态
C.实验I中,反应达到平衡后,再通入4molCO和2molH2O,平衡正向移动,H2的体积分数增大
D.若使用催化剂,会改变反应的途径,但反应的焓变不变
②实验I中,从反应开始到反应达到平衡时,CO的平均反应速率V(CO)=0.16mol/(L.min);
③实验II条件下反应的平衡常数K=0.33 (保留小数点后二位);H2O(g)的平衡转化率为50%.
④若在900℃时,实验II反应达到平衡后,向此容器中再加入1.5molCO、0.5mol H2O、0.2mol CO2、0.5mol H2,则平衡向正反应方向移动(填“正反应”、“逆反应”或“不移动”)
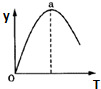
⑤若仅改变温度,纵坐标y随T变化如图所示,则纵坐标y表示的是AC.
A.CO2的百分含量 B.混合气体的平均相对分子质量C.CO的转化率 D.H2O的物质的量.
分析 ①A.可逆反应到达平衡时,各组分含量保持不变;
B.混合气体总质量不变,容器容积不变,混合气体的密度为定值;
C.实验I中,反应达到平衡后,再通入4molCO和2molH2O,增大反应物浓度,平衡正向移动,平衡状态等效为在原平衡基础上增大压强,与原平衡相比平衡不移动;
D.焓变与始态、终态有关,与反应途径无关;
②平衡时生成氢气为1.6mol,由方程式可知消耗的CO为1.6mol,根据v=$\frac{△c}{△t}$计算v(CO);
③平衡时生成氢气、二氧化碳均为0.5mol,由CO(g)+H2O(g)?CO2(g)+H2(g)可知,消耗的CO、水蒸气均为0.5mol,故平衡时CO为2mol-0.5mol=1.5mol,水蒸气为1mol-0.5mol=0.5mol,反应气体物质的量不变,用物质的量代替浓度代入K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$计算平衡常数;
④计算此时浓度商Qc,若Qc=K,处于平衡状态,若Qc<K,反应向正反应进行,若Qc>K,反应向逆反应进行;
⑤随温度升高,Y值先增大后减小,a点到达平衡状态,a点前未到达平衡,正反应为放热反应,a点后升高温度平衡逆向移动.
解答 解:①A.可逆反应到达平衡时,各组分含量保持不变,当容器中CO的含量保持不变时,说明该反应达到平衡状态,故A正确;
B.混合气体总质量不变,容器容积不变,混合气体的密度为定值,密度保持不变,不能说明到达平衡状态,故B错误;
C.实验I中,反应达到平衡后,再通入4molCO和2molH2O,平衡正向移动,等效为在原平衡基础上增大压强,与原平衡相比平衡不移动,氢气的体积分数相等,故C错误;
D.使用催化剂,降低活化能,改变反应途径,但焓变与始态、终态有关,与反应途径无关,故焓变不变,故D正确,
故选:AD;
②平衡时生成氢气为1.6mol,由方程式可知消耗的CO为1.6mol,则v(CO)=$\frac{\frac{1.6mol}{2L}}{5min}$=0.16mol/(L.min),
故答案为:0.16mol/(L.min);
③平衡时生成氢气、二氧化碳均为0.5mol,
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol) 2 1 0 0
变化量(mol) 0.5 0.5 0.5 0.5
平衡量(mol) 1.5 0.5 0.5 0.5
反应气体物质的量不变,用物质的量代替浓度计算平衡常数,故平衡常数K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$=$\frac{0.5×0.5}{1.5×0.5}$=0.33,水的转化率为$\frac{0.5mol}{1mol}$×100%=50%,
故答案为:0.33;50%;
④此时浓度商Qc=$\frac{(0.5+0.2)×(0.5+0.5)}{(1.5+1.5)×(0.5+0.5)}$=0.23<K=0.33,反应向正反应进行,
故答案为:正反应;
⑤随温度升高,Y值先增大后减小,a点到达平衡状态,a点前未到达平衡,正反应为放热反应,a点后升高温度平衡逆向移动.
A.CO2的百分含量,开始随反应增大,达到平衡升温平衡逆向进行二氧化碳减小,故A符合;
B.反应前后气体质量和物质的量不变,混合气体的平均相对分子质量始终不变,故B不符合;
C.CO的转化率开始随反应增大,达到平衡升温平衡逆向进行,一氧化碳转化率减小,故C符合;
D.H2O的物质的量先减小平衡后,随温度升高平衡逆向进行,水的量增大,故D不符合;
故答案为:AC.
点评 本题考查化学平衡计算与影响因素、平衡常数计算及应用、反应速率计算、平衡状态判断、化学平衡图象等,题目难度中等,掌握化学平衡常数的用途:1、判断反应进行的程度,2、判断反应的热效应,3、判断反应进行的方向,4、计算转化率等.

| A. | 将氯水滴入紫色石蕊溶液中,可以看到先变红后褪色 | |
| B. | 将氯水滴入硝酸银溶液,有白色沉淀生成 | |
| C. | 向氯水中滴加碳酸钠溶液,有气体产生 | |
| D. | 向氯水中滴加溴化钾溶液,下层出现橙红色 |
| A. | 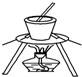 从食盐水中提取NaCl | B. | 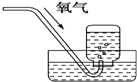 收集氧气 | ||
| C. | 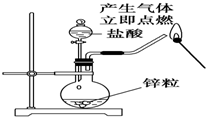 制备并检验氢气的可燃性 | D. | 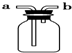 从a口进气可收集H2 |
| A. | Na2O2、NH4Cl、NaCl、Na2SO4 | B. | FeO、AlCl3、Na2SiO3、硝酸 | ||
| C. | KHCO3、Ca(OH)2、MgCl2、硫酸 | D. | NaCO3、BaCl2、K2S、盐酸 |
| A. | Na2O、Na2O2组成元素相同,与CO2反应产物也相同 | |
| B. | 含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1 mol•L-1 | |
| C. | Na的金属活动性比Mg强,故可用Na与MgCl2溶液反应制Mg | |
| D. | 1molNa2O2固体中含离子总数为3NA |
| A. | 加入H+有气体产生的溶液中:SO${\;}_{3}^{2-}$、Ba2+、K+、NO${\;}_{3}^{-}$ | |
| B. | 使酚酞显红色的溶液中:NO${\;}_{3}^{-}$、Cl-、K+、Ba2+ | |
| C. | 加铁粉能放出氢气的溶液中:Na+、H+、CH3COO-、Cl- | |
| D. | 呈酸性的无色溶液中:K+、Fe2+、NO32-、SO42- |
| A. | 用氯气制备漂白粉 | B. | 氯气和铜 | ||
| C. | 氯气和氢气 | D. | 浓盐酸与二氧化锰反应生成氯气 |