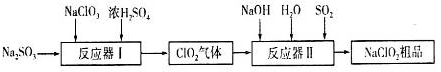
3.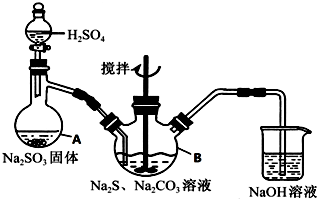 硫代硫酸钠(Na2S2O3•5H2O)俗名“大苏打”,又称为“海波”,可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等.它易溶于水,难溶于乙醇,加热、易分解,在酸性溶液中不能稳定存在.工业上常用亚硫酸钠法、硫化碱法等制备.某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:
硫代硫酸钠(Na2S2O3•5H2O)俗名“大苏打”,又称为“海波”,可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等.它易溶于水,难溶于乙醇,加热、易分解,在酸性溶液中不能稳定存在.工业上常用亚硫酸钠法、硫化碱法等制备.某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:
实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节分液的滴速,使反应产生的SO2气体较均匀地通入Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸.
②直至析出的浑浊不再消失,并控制溶液的pH接近7时,停止通入SO2气体.
③趁热过滤,将滤液加热浓缩,冷却析出Na2S2O3•5H2O.
④再经过滤、洗涤、干燥,得到所需的产品.
(1)步骤④中洗涤时,为了减少产物的损失用的试剂可以是乙醇.
(2)为了保证硫代硫酸钠的产量,实验中不能让溶液pH<7,请用离子方因S2O32-+2H+=S↓+SO2↑+H2O.
(3)写出三颈烧瓶B中制取Na2S2O3反应的总化学反应方程式4SO2+2Na2S+Na2CO3=CO2+3Na2S2O3.
(4)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00mL,控制适当的酸度加入足量 K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解,此时CrO${\;}_{4}^{2-}$全部转化为Cr2O${\;}_{7}^{2-}$;再加过量KI溶液,充分反应后得混合溶液V mL,将其平均分成4等份,加入淀粉溶液作指示剂,用0.0010mol.L-1 的Na2S2O3溶液进行滴定,反应完全时,相关数据记录如表所示:
部分反应离子方程式为:
①Cr2O${\;}_{7}^{2-}$+61-+14H+=2Cr3++3I2+7H2O; ②I2+2S2O${\;}_{3}^{2-}$=2I-+S4O${\;}_{6}^{2-}$.
①判断达到滴定终点的现象是加入最后一滴Na2S2O3标准溶液后,蓝色消失,且半分钟内颜色不改变
②从表格所给数据计算:一份待测溶液消耗Na2S2O3溶液的平均体积为18.00mL ml
③废水中Ba2+的物质的量浓度9.6×10-4mol•L-1.
(5)Na2S2O3常用作脱氯剂,在溶液中易被Cl2氧化成SO${\;}_{4}^{2-}$,该反应的离子方程式为S2O32?+4Cl2+5H2O=2SO42?+8Cl?+10H+.
 硫代硫酸钠(Na2S2O3•5H2O)俗名“大苏打”,又称为“海波”,可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等.它易溶于水,难溶于乙醇,加热、易分解,在酸性溶液中不能稳定存在.工业上常用亚硫酸钠法、硫化碱法等制备.某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:
硫代硫酸钠(Na2S2O3•5H2O)俗名“大苏打”,又称为“海波”,可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等.它易溶于水,难溶于乙醇,加热、易分解,在酸性溶液中不能稳定存在.工业上常用亚硫酸钠法、硫化碱法等制备.某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节分液的滴速,使反应产生的SO2气体较均匀地通入Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸.
②直至析出的浑浊不再消失,并控制溶液的pH接近7时,停止通入SO2气体.
③趁热过滤,将滤液加热浓缩,冷却析出Na2S2O3•5H2O.
④再经过滤、洗涤、干燥,得到所需的产品.
(1)步骤④中洗涤时,为了减少产物的损失用的试剂可以是乙醇.
(2)为了保证硫代硫酸钠的产量,实验中不能让溶液pH<7,请用离子方因S2O32-+2H+=S↓+SO2↑+H2O.
(3)写出三颈烧瓶B中制取Na2S2O3反应的总化学反应方程式4SO2+2Na2S+Na2CO3=CO2+3Na2S2O3.
(4)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00mL,控制适当的酸度加入足量 K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解,此时CrO${\;}_{4}^{2-}$全部转化为Cr2O${\;}_{7}^{2-}$;再加过量KI溶液,充分反应后得混合溶液V mL,将其平均分成4等份,加入淀粉溶液作指示剂,用0.0010mol.L-1 的Na2S2O3溶液进行滴定,反应完全时,相关数据记录如表所示:
| 编号 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3标准溶液的体积/mL | 18.02 | 17.98 | 18.00 | 20.03 |
①Cr2O${\;}_{7}^{2-}$+61-+14H+=2Cr3++3I2+7H2O; ②I2+2S2O${\;}_{3}^{2-}$=2I-+S4O${\;}_{6}^{2-}$.
①判断达到滴定终点的现象是加入最后一滴Na2S2O3标准溶液后,蓝色消失,且半分钟内颜色不改变
②从表格所给数据计算:一份待测溶液消耗Na2S2O3溶液的平均体积为18.00mL ml
③废水中Ba2+的物质的量浓度9.6×10-4mol•L-1.
(5)Na2S2O3常用作脱氯剂,在溶液中易被Cl2氧化成SO${\;}_{4}^{2-}$,该反应的离子方程式为S2O32?+4Cl2+5H2O=2SO42?+8Cl?+10H+.
20.化学与社会、生活密切相关.下列叙述错误的是( )
| A. | K2FeO4是新型水处理剂,其原理与明矾相同 | |
| B. | Fe2O3俗称铁红,常用作红色油漆和涂料 | |
| C. | 推广应用燃料“脱硫、脱硝”技术,可减少硫氧化物和氮氧化物对空气的污染 | |
| D. | Al2O3熔点高,可用于制作耐高温仪器 |
18.下列说法正确的是( )
| A. | 0.1mol/L的硫酸溶液中,H+物质的量为0.2mol | |
| B. | 0.1mol-NH2(氨基)中含有的电子数为0.7 mol | |
| C. | 30g SiO2中含有的Si-O键数目为2 mol | |
| D. | 0.1 mol SO2与足量O2反应,转移的电子数为0.2 mol |
17.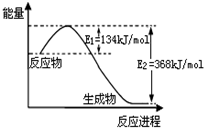 氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有着重要作用.
氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有着重要作用.
(1)一定温度下,在2L容积恒定的密闭容器中充入2mol N2和8mol H2并发生反应.10min达平衡,测得氨气的浓度为0.4mol/L,此时氮气的转化率为20%.
(2)如图是1mol NO2(g)和1mol CO(g)反应生成1mol CO2(g)和1mol NO(g)过程中能量变化示意图,写出该反应的热化学方程式:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234KJ/mol
(3)在容积恒定的密闭容器中,进行如下反应:
N2(g)+3H2(g)?2NH3(g)△H<0,其平衡常数K与温度T的关系如下表:
①写出该反应的平衡常数表达式:K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$;
②试判断K1>K2(填写“>”“=”或“<”);
③NH3(g)燃烧的方程式为4NH3(g)+7O2(g)═4NO2(g)+6H2O(l),已知:
2H2(g)+O2(g)═2H2O(l)△H=-483.6kJ/mol N2(g)+2O2(g)═2NO2 (g)△H=+67.8kJ/mol
N2(g)+3H2(g)═2NH3 (g)△H=-92.0kJ/mol 则NH3 (g)的燃烧热282.8kJ/mol.
(4)常温1L0.1mol•L-1醋酸与1L0.1mol•L-1氨水反应,放出的热量为a kJ,写出此离子反应的热化学方程式CH3COOH(aq)+NH3•H2O(aq)=CH3COO-(aq )+NH4+ (aq )+H2O(l)△H=-10akJ/mol.
 氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有着重要作用.
氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有着重要作用.(1)一定温度下,在2L容积恒定的密闭容器中充入2mol N2和8mol H2并发生反应.10min达平衡,测得氨气的浓度为0.4mol/L,此时氮气的转化率为20%.
(2)如图是1mol NO2(g)和1mol CO(g)反应生成1mol CO2(g)和1mol NO(g)过程中能量变化示意图,写出该反应的热化学方程式:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234KJ/mol
(3)在容积恒定的密闭容器中,进行如下反应:
N2(g)+3H2(g)?2NH3(g)△H<0,其平衡常数K与温度T的关系如下表:
| T/K | 398 | 498 |
| 平衡常数K | K1 | K2 |
②试判断K1>K2(填写“>”“=”或“<”);
③NH3(g)燃烧的方程式为4NH3(g)+7O2(g)═4NO2(g)+6H2O(l),已知:
2H2(g)+O2(g)═2H2O(l)△H=-483.6kJ/mol N2(g)+2O2(g)═2NO2 (g)△H=+67.8kJ/mol
N2(g)+3H2(g)═2NH3 (g)△H=-92.0kJ/mol 则NH3 (g)的燃烧热282.8kJ/mol.
(4)常温1L0.1mol•L-1醋酸与1L0.1mol•L-1氨水反应,放出的热量为a kJ,写出此离子反应的热化学方程式CH3COOH(aq)+NH3•H2O(aq)=CH3COO-(aq )+NH4+ (aq )+H2O(l)△H=-10akJ/mol.
16.在恒温恒容的容器中发生N2O4(g)?2NO2(g),若反应物的浓度由0.1mol•L-1降到0.06mol•L-1需20s,那么由0.06mol•L-1降到0.036mol•L-1,所需反应时间为( )
| A. | 10 s | B. | 12 s | C. | 大于12 s | D. | 小于12 s |
14.下列反应既属于化合反应,又属于氧化还原反应的是( )
0 173760 173768 173774 173778 173784 173786 173790 173796 173798 173804 173810 173814 173816 173820 173826 173828 173834 173838 173840 173844 173846 173850 173852 173854 173855 173856 173858 173859 173860 173862 173864 173868 173870 173874 173876 173880 173886 173888 173894 173898 173900 173904 173910 173916 173918 173924 173928 173930 173936 173940 173946 173954 203614
| A. | 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O | B. | CO2+H2O═H2CO3 | ||
| C. | Fe+H2SO4=FeSO4+H2↑ | D. | MgCO3+2HCl═2HCl2+CO2↑+H2O |