题目内容
16.在恒温恒容的容器中发生N2O4(g)?2NO2(g),若反应物的浓度由0.1mol•L-1降到0.06mol•L-1需20s,那么由0.06mol•L-1降到0.036mol•L-1,所需反应时间为( )| A. | 10 s | B. | 12 s | C. | 大于12 s | D. | 小于12 s |
分析 随着反应物浓度的减小,化学反应速率减慢,反应所需时间增多,依此解答.
解答 解:反应物的浓度由0.1mol•L-1降到0.06mol•L-1需20s,即反应物的浓度变化为0.1-0.06=0.04mol•L-1,
反应物的浓度由0.06mol•L-1降到0.036mol•L-,即反应物的浓度变化为0.06-0.036=0.024mol•L-1,若反应速率不变,则所需时间为$\frac{0.024}{0.04}$=12s,但随着浓度的减小,反应速率逐渐减小,故所需时间大于12s,
故选C.
点评 本题考查难度对化学反应速率的影响,注意化学反应速率概念的计算应用,难度不大.

练习册系列答案
相关题目
6.化学与社会、生产、生活紧密相关,下列说法正确的是( )
| A. | 自来水可用氯气来杀菌消毒,说明氯气无毒 | |
| B. | 福尔马林可作食品的保鲜剂 | |
| C. | 目前我市的汽油标准己由“国III”提到“国Ⅳ”,这意味着汽车不再排放氮氧化物 | |
| D. | 推广使用可降解塑料及布质购物袋,以减少“白色污染” |
7.化学与生产生活实际密切联系.下列说法不正确的是( )
| A. | 氢能可再生,没有污染,现已用作火箭和燃料电池的燃料 | |
| B. | 在环保领域,酸性或碱性废水的处理常常利用中和反应 | |
| C. | 为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 | |
| D. | 工业生产中,使用催化剂能加快化学反应速率,提高反应物的转化率 |
4.2.6g Zn与200ml 0.1mol/L的稀HNO3溶液恰好完全反应,Zn被氧化成Zn2+,则HNO3的还原产物可能为( )
| A. | H2 | B. | NO2 | C. | NO | D. | N2O |
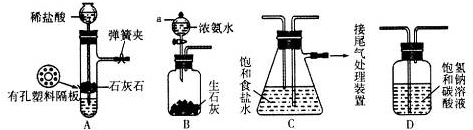
11.用下列装置不能达到有关实验目的是( )
| A. |  证明非金属性强弱S>C>Si | |
| B. |  制备并收集少量NO气体 | |
| C. |  制取并收集干燥纯净的NH3 | |
| D. |  制备Fe(OH)2并能较长时间观察其颜色 |
8.用惰性电极电解一定量的硫酸铜溶液,实验装置如图甲.电解过程中的实验数据如图乙,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况).则下列说法不正确的是
( )

( )

| A. | 电解过程中,a 电极表面先有红色物质析出,后有气泡产生 | |
| B. | b 电极上发生反应的方程式为:4OH--4e-=2H2O+O2↑ | |
| C. | 曲线 O~P 段表示 O2 的体积变化 | |
| D. | 从开始到 Q 点时收集到的混合气体的平均摩尔质量为 12 g/mol |
5.I:室温时,现有①0.01mol/LHA ②0.01mol/LMOH ③pH=2的HA ④pH=12的MOH ⑤0.01mol/LMA ⑥等体积的①和④的混合溶液 六种溶液(已知lg2=0.3,lg3=0.5)
(1)如果要用最简单的方法证明HA为弱酸,只能用上述溶液和必要的化学仪器、实验用品;你的正确的操作是在表面皿(或玻璃片)上放一小片试纸,用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,与标准比色卡对比来确定pH.
(2)水的电离程度:④<⑥(填>、<或=)
(3)如果HA为弱酸,则向③中加入等体积PH=2的盐酸后,溶液中所有离子浓度由大到小的顺序为c(H+)>c(Cl-)=c(A-)>c(OH-).
(4)如果HA为强酸,MOH为强碱,把①和④按体积比1:4混合,则混合后溶液的PH=11.8.
II:常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
请回答下列问题:(1)a>7(填“>”“<”或“=”).
(2)不考虑其他组的实验结果,单从丁组情况分析,写出HA电离方程式H?H++A-.
(3)从乙、丁组情况分析,c1>0.2 (填“>”“<”或“=”).
(1)如果要用最简单的方法证明HA为弱酸,只能用上述溶液和必要的化学仪器、实验用品;你的正确的操作是在表面皿(或玻璃片)上放一小片试纸,用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,与标准比色卡对比来确定pH.
(2)水的电离程度:④<⑥(填>、<或=)
(3)如果HA为弱酸,则向③中加入等体积PH=2的盐酸后,溶液中所有离子浓度由大到小的顺序为c(H+)>c(Cl-)=c(A-)>c(OH-).
(4)如果HA为强酸,MOH为强碱,把①和④按体积比1:4混合,则混合后溶液的PH=11.8.
II:常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 | HA物质的量 浓度(mol/L) | NaOH物质的 量浓度(mol/L) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c1 | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
(2)不考虑其他组的实验结果,单从丁组情况分析,写出HA电离方程式H?H++A-.
(3)从乙、丁组情况分析,c1>0.2 (填“>”“<”或“=”).