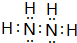题目内容
2.许多含氯物质与生活密切相关,如HClO、ClO2、NaClO2等都是重要的杀菌消毒剂和漂白剂.其中制备NaClO2的工业流程如图所示: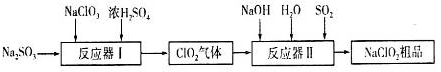
请回答下列问题:
(1)反应器I中反应的氧化剂是NaClO3.
(2)反应器Ⅱ中发生反应的离子方程式为2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2O.
(3)通入反应器Ⅱ中的SO2能用H2O2代替,请简要说明理由H2O2有还原性也能把ClO2还原为NaClO2.
(4)为了测定NaClO2粗品的纯度,取上述粗产品10.0g溶于水配成1L溶液,取出10mL,溶液于锥形瓶中,再加入足量酸化的KI溶液.充分反应后(NaClO2被还原为Cl-,杂质不参加反应),加入2~3滴淀粉溶液,用0.20mol•L-1Na2S2O3标准液滴定,达到滴定达终点时用去标准液20.00mL,试计算NaClO2粗品的纯度90.5%.(提示:2Na2S2O3+I2═Na2S4O6+2NaI)
分析 根据题中流程,发生器中NaClO3在酸性条件下被还原成ClO2,在吸收塔中ClO2在碱性条件下被二氧化硫还原成NaClO2,NaClO2的溶解度随温度升高而增大,通过蒸发浓缩,冷却结晶,过滤洗涤得到晶体NaClO2.
(1)根据加入到反应器Ⅰ中的原料有NaClO3、浓硫酸、Na2SO3,生成物有ClO2气体根据反应物和生成物的化合价的变化,有元素化合价降低的反应物为氧化剂;
(2)根据通入到反应容器Ⅱ中的反应物有NaOH、SO2、H2O、ClO2,生成物有NaClO2,氯的化合价由+4价变成了+3价,得到电子,根据氧化还原反应的原理硫应失电子,由+4价变成+6价,根据氧化还原反应原理的氧化剂得到电子总数等于还原剂失去电子的总数,书写出氧化还原反应方程式:2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2O;
(3)如果将反应器Ⅱ中的SO2 用H2O2 代替同样能生成NaClO2,说明变换物质后,氧化还原反应照样能发生生成NaClO2,也就说明H2O2也具有还原性,也能把ClO2还原为
NaClO2;
(4)根据反应:ClO2-+4I-+4H+=Cl-+2I2+2H2O,以及2Na2S2O3+I2═Na2S4O6+2NaI,可得反应的关系式:ClO2-~2I2~4Na2S2O3,根据关系式计算.
解答 解:(1)根据加入到反应器Ⅰ中的原料有NaClO3、浓硫酸、Na2SO3,生成物有ClO2气体,依据书写化学方程式的规则,即发生化学反应时满足原子的种类和数目不变,书写出化学反应方程式为:2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O,Cl的化合价(+5→+4),NaClO3为氧化剂,
故答案为:NaClO3;
(2)根据通入到反应容器Ⅱ中的反应物有NaOH、SO2、H2O、ClO2,生成物有NaClO2,氯的化合价由+4价变成了+3价,得到电子,根据氧化还原反应的原理硫应失电子,由+4价变成+6价,根据氧化还原反应原理的氧化剂得到电子总数等于还原剂失去电子的总数,则氧化还原反应方程式为2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2O,
故答案为:2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2O;
(3)如果将反应器Ⅱ中的SO2 用H2O2 代替同样能生成NaClO2,说明变换物质后,氧化还原反应照样能发生生成NaClO2,也就说明H2O2也具有还原性,也能把ClO2还原为
NaClO2,
故答案为:H2O2有还原性也能把ClO2还原为NaClO2;
(4)取上述合成产品10g溶于水配成1L溶液,取出10mL溶液于锥形瓶中,再加入足量酸化的KI溶液,发生ClO2-+4I-+4H+=Cl-+2I2+2H2O,充分反应后加入2~3滴淀粉溶液,溶液变蓝,用0.20mol/L Na2S2O3标准液滴定,发生:2Na2S2O3+I2═Na2S4O6+2NaI,蓝色变为无色,
可得反应的关系式为:ClO2-~2I2~4Na2S2O3,又n(Na2S2O3)=0.20mol/L×0.02L=0.004mol,
则ClO2-~2I2~4Na2S2O3
1 4
n(ClO2-) 0.004mol n(ClO2-)=0.001mol,所以1L溶液中含有:n(NaClO2)=0.001mol×100=0.1mol,
则10g合成产品中含有:m(NaClO2)=0.1mol×90.5g/mol=0.905g,NaClO2粗品的纯度为$\frac{0.905g}{10g}$×100%=90.5%,
故答案为:90.5%.
点评 本题是一道化工生产制备NaClO2的工艺流程,需要把握住工艺流程的过程,找到解决问题的突破口,运用基本知识、结合最终要得到的产品来解决,要将教材所学到的基本知识应用到实际解决问题中去,要求基础知识掌握牢固,同时又能将基础知识应用实际应用中,题目难度中等.

| A. | 紧闭门窗,防止装修面干裂或变质 | |
| B. | 适度开窗通风,充分进行室内外空气对流 | |
| C. | 请专业环境监测人员进行检测 | |
| D. | 在各个房间均匀地适量放置吊兰、芦荟等 |
(1)钼位于第五周期VIB族.与钼相邻的上一周期同族元素的符号为Cr;该元素基态原子的电子最后排布的能级为3d,该能级上总的电子数为5.
(2)碳和硫有关数据如表:
| 元素 | 原子半径 | 电负性 | 第一电离能 |
| C | 67pm | 2.55 | 1125.8kJ/mol |
| S | 88pm | 2.58 | 1036.7kJ/mol |
②写出能证明该结论的化学方程式H2SO4+Na2CO3=Na2SO4+CO2↑+H2O.
(3)从不同角度观察MoS2的晶体结构如图1,2,根据MoS2的晶体结构回答:
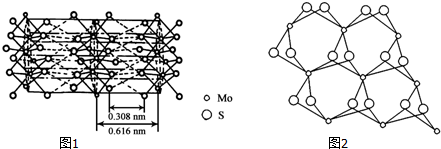
①钼的配位数为6.
②Mo与S之间的化学键为AC(填序号).
A.极性键 B.非极性键 C.配位键 D.金属键 E.范德华力
③辉钼纳米粒子的润滑性能非常优异,其原因是MoS2具有层状结构,Mo和S同层间以共价键结合,层与层之间通过范德华力结合,外力作用层与层易发生相对滑动.
(4)硅与碳在高温下反应可得到金刚砂(SiC),其结构与金刚石结构相似,若将金刚石晶体中一半的C原子换成Si原子且同种原子不成键,则得的金刚砂(SiC)结构.如果我们以一个硅原子为中心,设SiC晶体中硅原子与其最近的碳原子的最近距离为d,则与硅原子次近的第二层有12个原子,其离中心原子的距离是$\frac{2\sqrt{6}}{3}$d.
| A. | 加热灼烧海带时要在蒸发皿中进行 | |
| B. | 蒸馏时,水从冷凝管上部通入,从下部流出 | |
| C. | 向某溶液中加入AgNO3溶液,生成白色沉淀,该溶液一定含有Cl- | |
| D. | 分液时,碘的四氯化碳溶液从分液漏斗下口放出,水层从上口倒出 |
 氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有着重要作用.
氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有着重要作用.(1)一定温度下,在2L容积恒定的密闭容器中充入2mol N2和8mol H2并发生反应.10min达平衡,测得氨气的浓度为0.4mol/L,此时氮气的转化率为20%.
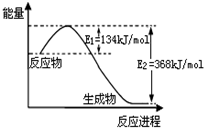
(2)如图是1mol NO2(g)和1mol CO(g)反应生成1mol CO2(g)和1mol NO(g)过程中能量变化示意图,写出该反应的热化学方程式:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234KJ/mol
(3)在容积恒定的密闭容器中,进行如下反应:
N2(g)+3H2(g)?2NH3(g)△H<0,其平衡常数K与温度T的关系如下表:
| T/K | 398 | 498 |
| 平衡常数K | K1 | K2 |
②试判断K1>K2(填写“>”“=”或“<”);
③NH3(g)燃烧的方程式为4NH3(g)+7O2(g)═4NO2(g)+6H2O(l),已知:
2H2(g)+O2(g)═2H2O(l)△H=-483.6kJ/mol N2(g)+2O2(g)═2NO2 (g)△H=+67.8kJ/mol
N2(g)+3H2(g)═2NH3 (g)△H=-92.0kJ/mol 则NH3 (g)的燃烧热282.8kJ/mol.
(4)常温1L0.1mol•L-1醋酸与1L0.1mol•L-1氨水反应,放出的热量为a kJ,写出此离子反应的热化学方程式CH3COOH(aq)+NH3•H2O(aq)=CH3COO-(aq )+NH4+ (aq )+H2O(l)△H=-10akJ/mol.

| A. | 用甲图装置电解精炼铝 | |
| B. | 用乙图装置制备 Fe(OH)2 | |
| C. | 用丙图装置可制得金属锰 | |
| D. | 用丁图装置验证 NaHCO3 和 Na2CO3的热稳定性 |
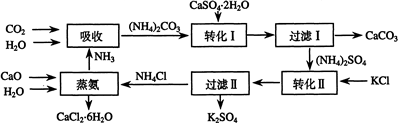
(1)本工艺中所用的原料除CaSO4•2H2O、KCl外,还需要CaCO3、(或CaO)、NH3、H2O等原料
(2)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式:
CaSO4+CO32-=CaCO3+SO42-
(3)过滤Ⅰ操作所得固体中,除CaCO3外还含有CaSO4(填化学式)等物质,该固体可用作生产水泥的原料.
(4)过滤Ⅰ操作所得滤液是(NH4)2SO4溶液.检验滤液中含有CO32-的方法是:取少量溶液,滴加稀盐酸,若有气泡产生则还含有CO32-,
反之则不含有CO32-.
(5)已知不同温度下K2SO4在100g水中达到饱和时溶解的量如表:
| 温度(℃) | 0 | 20 | 60 |
| K2SO4溶解的量(g) | 7.4 | 11.1 | 18.2 |
(6)氯化钙结晶水合物(CaCl2•6H2O)是目前常用的无机储热材料,选择的依据是Ad
A、熔点较低(29℃熔化) b、能导电 c、能制冷 d、无毒
(7)上述工艺流程中体现绿色化学理念的是:碳酸钙用于制水泥原料、硫酸钙和氯化钾转化为硫酸钾和氯化钙、氨在工艺中循环使用等
原子利用率高,没有有害物质排放到环境中.
| A. | 还原性:X->Y- | |
| B. | 在X-、Y-、Z-、W- 中 Z- 的还原性最强 | |
| C. | 氧化性:Z2>W2 | |
| D. | 反应2Z-+Y2=2Y-+Z2可以发生 |