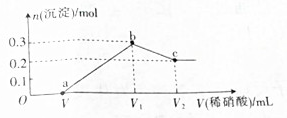
5.某合金只含Al、Fe、Cu,为分析其组成,称取ag样品,设计下列实验流程:
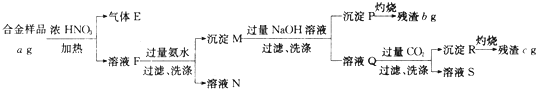
下列相关叙述不正确的是( )

下列相关叙述不正确的是( )
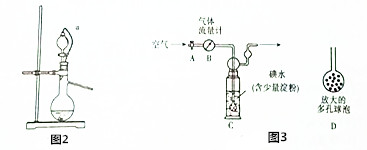
| A. | 气体E呈红棕色,不能直接排放 | |
| B. | 溶液S中所含溶质、沉淀R都可用作药物 | |
| C. | 合金样品中Cu的质量分数为$\frac{a-b-c}{a}$×100% | |
| D. | 合金样品中Al的质量分数为$\frac{9c}{17a}$×100% |
4.有Fe、CuO和Fe2O3组成的混合物共mg,放入500mL lmol•L-1 HNO3溶液中,混合物完全溶解,生成2.24L(标准状况下)NO,再向反应后的溶液中加入200mLNaOH溶液,要使铁和铜元素完全沉淀下来,所加入的NaOH溶液的浓度最小是( )
| A. | 1 mol•L-1 | B. | 1.5 mol•L-1 | C. | 2 mol•L-1 | D. | 2.5 mol•L-1 |
1.已知:工业上制硫酸在接触室中发生的反应为:2SO2(g)+O2(g)?2SO3(g),其正反应是一个放热反应.
(1)①相同条件下,2mol SO2和1mol O2所具有的能量>(填“>”、“<”或“=”)2mol SO3具有的能量;
②在相同条件下,若断开2mol SO2、1molO2和2mol SO3中的化学键时,吸收的能量分别为Q1、Q2、Q3,则Q1+Q2<Q3(填“>”、“<”或“=”);
③在一定条件下,当该反应生成2molSO3时,放出197kJ的热量,该条件下,如果将3mol SO2和1mol O2混合,使其充分反应,放出的热量<197kJ(填“>”、“<”或“=”),反应达到平衡后,n(SO2)+n(SO3)=3mol.
(2)科研人员设想用如图所示装置生产硫酸,
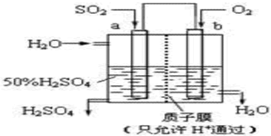
①通入O2的b极是原电池正极(填“正”或“负”);
②电解质溶液中阴离子向a极移动(填“a”或“b”);
③负极反应式为2SO2-4e-+4H2O=2SO42-+8H+.
(3)将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入0.5L密闭容器内,550℃时,在催化剂作用下充分发生反应.测得n(O2)随时间的变化如下表
反应达到5s后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了22.4L(此体积为标准状况下的体积);再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(此体积为标准状况下的体积).
请回答下列问题:
①用O2表示从1~2s内该反应的平均反应速率为0.2mol•L-1•s-1;
②该反应达到平衡时,SO2的转化率为90%(用百分数表示);
③该反应达到平衡时,O2的体积分数是6.2%(用百分数表示);
④若反应在绝热密闭系统中进行时,其余条件不变,反应速率是先增大后减小,其原因可能是:该反应是放热反应,反应开始后放出的热量使体系的温度升高,反应速率加快;一段时间后,随着浓度的减小,化学反应速率减慢.
(1)①相同条件下,2mol SO2和1mol O2所具有的能量>(填“>”、“<”或“=”)2mol SO3具有的能量;
②在相同条件下,若断开2mol SO2、1molO2和2mol SO3中的化学键时,吸收的能量分别为Q1、Q2、Q3,则Q1+Q2<Q3(填“>”、“<”或“=”);
③在一定条件下,当该反应生成2molSO3时,放出197kJ的热量,该条件下,如果将3mol SO2和1mol O2混合,使其充分反应,放出的热量<197kJ(填“>”、“<”或“=”),反应达到平衡后,n(SO2)+n(SO3)=3mol.
(2)科研人员设想用如图所示装置生产硫酸,

①通入O2的b极是原电池正极(填“正”或“负”);
②电解质溶液中阴离子向a极移动(填“a”或“b”);
③负极反应式为2SO2-4e-+4H2O=2SO42-+8H+.
(3)将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入0.5L密闭容器内,550℃时,在催化剂作用下充分发生反应.测得n(O2)随时间的变化如下表
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(O2)/mol | 0.7 | 0.4 | 0.3 | x | x | x |
请回答下列问题:
①用O2表示从1~2s内该反应的平均反应速率为0.2mol•L-1•s-1;
②该反应达到平衡时,SO2的转化率为90%(用百分数表示);
③该反应达到平衡时,O2的体积分数是6.2%(用百分数表示);
④若反应在绝热密闭系统中进行时,其余条件不变,反应速率是先增大后减小,其原因可能是:该反应是放热反应,反应开始后放出的热量使体系的温度升高,反应速率加快;一段时间后,随着浓度的减小,化学反应速率减慢.
1.下列过程中,化学键发生断裂的是( )
0 173680 173688 173694 173698 173704 173706 173710 173716 173718 173724 173730 173734 173736 173740 173746 173748 173754 173758 173760 173764 173766 173770 173772 173774 173775 173776 173778 173779 173780 173782 173784 173788 173790 173794 173796 173800 173806 173808 173814 173818 173820 173824 173830 173836 173838 173844 173848 173850 173856 173860 173866 173874 203614
| A. | 挥发 | B. | 电解 | C. | 萃取 | D. | 蒸馏 |
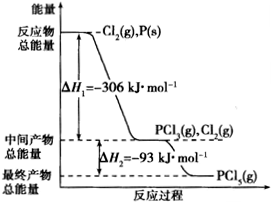 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中△H的表示生成1mol产物的数据).
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中△H的表示生成1mol产物的数据).

 根据图示填空:
根据图示填空: