19.草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸亚铁晶体的化学性质,进行了一系列实验探究.
(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到二氧化碳气体生成.这说明草酸亚铁晶体具有还原性(填“氧化性”、“还原性”或“碱性”).若反应中消耗1.5mol FeC2O4•2H2O,则参加反应的KMnO4为0.9mol.
(2)资料表明:在密闭容器中加热到一定温度时,草酸亚铁晶体可完全分解,生成几种氧化物,残留物为黑色固体.课题组根据课本上所介绍的铁的氧化物的性质,对黑色固体的组成提出如下假设,请你完成假设二和假设三:
假设一:全部是FeO 假设二:全部是Fe3O4 假设三:FeO和Fe3O4
(3)为验证上述假设一是否成立,课题组进行如下研究.
【定性研究】请你完成如表中内容.
【定量研究】课题组在文献中查阅到,FeC2O4•2H2O受热分解时,固体质量随温度变化的曲线如图所示,写出加热到400℃时,FeC2O4•2H2O晶体受热分解的化学方程式为:FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$FeO+CO↑+CO2↑+2H2O或FeC2O4$\frac{\underline{\;\;△\;\;}}{\;}$FeO+CO↑+CO2↑.
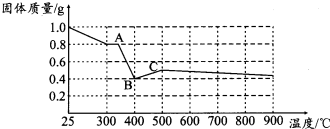
根据图象,如有1.0g草酸亚铁晶体在坩埚中敞口充分加热,最终残留黑色固体的质量大于0.4g.某同学由此得出结论:假设一不成立.你是否同意该同学的结论,并简述理由:不同意,实验未在密闭容器中进行,FeO会被空气中的氧气进一步氧化,生成的铁的其它氧化物.
(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到二氧化碳气体生成.这说明草酸亚铁晶体具有还原性(填“氧化性”、“还原性”或“碱性”).若反应中消耗1.5mol FeC2O4•2H2O,则参加反应的KMnO4为0.9mol.
(2)资料表明:在密闭容器中加热到一定温度时,草酸亚铁晶体可完全分解,生成几种氧化物,残留物为黑色固体.课题组根据课本上所介绍的铁的氧化物的性质,对黑色固体的组成提出如下假设,请你完成假设二和假设三:
假设一:全部是FeO 假设二:全部是Fe3O4 假设三:FeO和Fe3O4
(3)为验证上述假设一是否成立,课题组进行如下研究.
【定性研究】请你完成如表中内容.
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 取少量黑色固体加入足量稀盐酸(或稀硫酸)溶解, 在溶液中滴加KSCN溶液 | 若溶液不变红色,则假设一成立. 若溶液变红色,则假设一不成立 |

根据图象,如有1.0g草酸亚铁晶体在坩埚中敞口充分加热,最终残留黑色固体的质量大于0.4g.某同学由此得出结论:假设一不成立.你是否同意该同学的结论,并简述理由:不同意,实验未在密闭容器中进行,FeO会被空气中的氧气进一步氧化,生成的铁的其它氧化物.
15.将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s)?2G(g).忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如表所示:
①b<f ②915℃、2.0MPa时E的转化率为60%③该反应的△S>0 ④K(1000℃)<K(810℃)
上述①~④中正确的有( )
压强/MPa 体积分数/% 温度/℃ | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
上述①~④中正确的有( )
| A. | ① | B. | ②④ | C. | ①②③ | D. | ①②③④ |
14.水热法制备纳米颗粒Y(化合物)的反应为:3Fe2++2S2O32-+O2+aOH-═Y+S4O62-+2H2O.下列有关该反应的说法中,不正确的是( )
| A. | a=4 | B. | 还原剂是Fe2+ | ||
| C. | 氧化剂是O2 | D. | Y的化学式为Fe3O4 |
13.下列离子方程式书写正确的是( )
| A. | 过量CO2通入偏铝酸钠溶液中:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| B. | 向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O═HClO+HSO${\;}_{3}^{-}$ | |
| C. | 酸性条件下双氧水和KI溶液反应:2I-+H2O2+2H+═I2+2H2O | |
| D. | 碳酸氢铵溶液与足量的KOH溶液混合后加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O |
12.下列实验操作不正确的是( )
| A. | 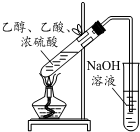 实验室中制取少量的乙酸乙酯 | |
| B. |  比较硫、碳、硅三种元素的非金属性强弱 | |
| C. |  处理尾气 | |
| D. | 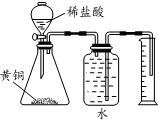 测定黄铜(Cu、Zn合金)中Zn 的含量 |
11.根据表中信息,判断下列叙述中正确的是( )
| 序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | - | Cl- | |
| ② | KClO3 | 浓盐酸 | - | Cl2 | |
| ③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
| A. | 表中②组反应的还原产物是KCl,电子转移数目是6e- | |
| B. | 氧化性强弱的比较:KClO3>Fe3+>Cl2>Br2 | |
| C. | 表中①组的反应可能有一种或两种元素被氧化 | |
| D. | 表中③组反应的离子方程式为:2MnO${\;}_{4}^{-}$+3H2O2+6H+═2Mn2++4O2↑+6H2O |
10.下列各组溶液中,各离子一定能大量共存的是( )
0 173661 173669 173675 173679 173685 173687 173691 173697 173699 173705 173711 173715 173717 173721 173727 173729 173735 173739 173741 173745 173747 173751 173753 173755 173756 173757 173759 173760 173761 173763 173765 173769 173771 173775 173777 173781 173787 173789 173795 173799 173801 173805 173811 173817 173819 173825 173829 173831 173837 173841 173847 173855 203614
| A. | pH=1的溶液:Cu2+、Na+、NO3-、SO42- | |
| B. | 滴加紫色石蕊试液显红色的溶液:Fe2+、NH4+、Cl-、NO3- | |
| C. | 水电离出来的c(H+)=10-12mol/L的溶液:K+、Mg2+、SiO32-、Br- | |
| D. | 滴入KSCN显血红色的溶液中:Na+、Ba2+、Cl-、OH- |
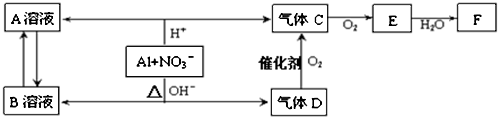
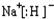 ;CA与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑.
;CA与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑.