9.常温下,下列各组离子在指定溶中一定能大量共存的是( )
| A. | 0.1mol•L-1(NH4)2Fe(SO4)2溶液中:K+、Cu2+、Cl-、MnO${\;}_{4}^{-}$、 | |
| B. | 滴入甲基橙显红色的溶液中:NH${\;}_{4}^{+}$、Ba2+、Al3+、CH3COO- | |
| C. | $\frac{{K}_{w}}{c({H}^{+})}$=10-130.1mol•L-1的溶液中:Fe3+、NH${\;}_{4}^{+}$、Mg2+、SO${\;}_{4}^{2-}$ | |
| D. | 能溶解Al2O3的溶液中:Mg2+、Fe3+、AlO${\;}_{2}^{-}$、HCO${\;}_{3}^{-}$ |
6.除去下列物质中的杂质(括号内为杂质),所选用的试剂及操作方法均正确的一组是( )
| 选项 | 待提纯的物质 | 选用的试剂 | 操作的方法 |
| A | CaO(CaCO3) | 水 | 溶解、过滤、结晶 |
| B | Cu(CuO) | 稀盐酸 | 溶解、过滤、洗涤、干燥 |
| C | CuSO4(H2SO4) | 氢氧化钠溶液 | 过滤 |
| D | ZnSO4(CuSO4) | Zn(OH)2 | 溶解、过滤 |
| A. | A | B. | B | C. | C | D. | D |
5. 甲醇是重要的化工原料,又可称为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
甲醇是重要的化工原料,又可称为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)?CH3OH(g)△H1
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)?CO(g)+H2O(g)△H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:(其中CO中的碳氧键为C$\frac{\underline{\;←\;}}{\;}$O)
由此计算△H1=-99kJ•mol-1,已知△H2=-58kJ•mol-1,则△H3=+41kJ•mol-1.
(2)在25℃、101KPa下,每充分燃烧1g CH3OH并恢复到原状态,会释放22.68KJ的热量.请写出表示甲醇燃烧热的热化学反应方程式:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-725.76kJ•mol-1.
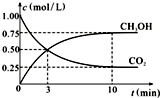
(3)对于第二个反应方程式:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),在一恒温恒容密闭容器中充入1molCO2和3mol H2,进行上述反应.测得CO2和CH3OH(g)的浓度随时间变化如图所示.试回答:0~10min内,氢气的平均反应速率为0.225mol•L-1•mm-1.该反应平衡常数表达式$\frac{c(C{H}_{3}OH)•c({H}_{2}O)}{c(C{O}_{2})•{c}^{3}({H}_{2})}$.第10min后,若向该容器中再充入1mol CO2和3mol H2,则再次达到平衡时CH3OH(g)的体积分数变大(填“变大”、“减少”或“不变”).该反应的平衡常数不变(填“变大”、“变小”或“不变”).
 甲醇是重要的化工原料,又可称为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
甲醇是重要的化工原料,又可称为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:①CO(g)+2H2(g)?CH3OH(g)△H1
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)?CO(g)+H2O(g)△H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:(其中CO中的碳氧键为C$\frac{\underline{\;←\;}}{\;}$O)
| 化学键 | H-H | C-O | C$\frac{\underline{\;←\;}}{\;}$O | H-O | C-H |
| E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
(2)在25℃、101KPa下,每充分燃烧1g CH3OH并恢复到原状态,会释放22.68KJ的热量.请写出表示甲醇燃烧热的热化学反应方程式:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-725.76kJ•mol-1.
(3)对于第二个反应方程式:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),在一恒温恒容密闭容器中充入1molCO2和3mol H2,进行上述反应.测得CO2和CH3OH(g)的浓度随时间变化如图所示.试回答:0~10min内,氢气的平均反应速率为0.225mol•L-1•mm-1.该反应平衡常数表达式$\frac{c(C{H}_{3}OH)•c({H}_{2}O)}{c(C{O}_{2})•{c}^{3}({H}_{2})}$.第10min后,若向该容器中再充入1mol CO2和3mol H2,则再次达到平衡时CH3OH(g)的体积分数变大(填“变大”、“减少”或“不变”).该反应的平衡常数不变(填“变大”、“变小”或“不变”).
4.在恒容的密闭容器中,将一定量的CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)?COS(g)+H2(g),K=0.1.反应前CO物质的量为10mol,平衡后CO物质的量为8mol.下列说法正确的是( )
| A. | 升高温度,H2S浓度增加,表明正反应是吸热反应 | |
| B. | 反应前H2S物质的量为7mol | |
| C. | 通入CO后,正反应速率逐渐增大,逆反应速率减小 | |
| D. | CO的平衡转化率为80% |
3.以下微粒含配位键的是( )
①N2H4 ②Na3AlF6 ③OH- ④NH4+ ⑤PCl3 ⑥Fe(SCN)3 ⑦H3O+⑧[Ag(NH3)2]OH.
①N2H4 ②Na3AlF6 ③OH- ④NH4+ ⑤PCl3 ⑥Fe(SCN)3 ⑦H3O+⑧[Ag(NH3)2]OH.
| A. | ①②④⑤⑦⑧ | B. | ④⑤⑥⑦⑧ | C. | ②④⑥⑦⑧ | D. | 全部 |
2.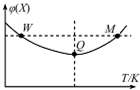 在2L恒容密闭容器中充入2mol X和1mol Y发生反应:2X(g)+Y(g)?3Z(g),反应过程持续升高温度,测得X的体积分数与温度的关系如图所示.下列推断正确的是( )
在2L恒容密闭容器中充入2mol X和1mol Y发生反应:2X(g)+Y(g)?3Z(g),反应过程持续升高温度,测得X的体积分数与温度的关系如图所示.下列推断正确的是( )
 在2L恒容密闭容器中充入2mol X和1mol Y发生反应:2X(g)+Y(g)?3Z(g),反应过程持续升高温度,测得X的体积分数与温度的关系如图所示.下列推断正确的是( )
在2L恒容密闭容器中充入2mol X和1mol Y发生反应:2X(g)+Y(g)?3Z(g),反应过程持续升高温度,测得X的体积分数与温度的关系如图所示.下列推断正确的是( )| A. | Q点时,Y的转化率最大 | |
| B. | 升高温度,平衡常数增大 | |
| C. | W点X的正反应速率等于M点X的正反应速率 | |
| D. | 平衡时充入Z,达到新平衡时Z的体积分数增大 |
1.下列有关说法不正确的是( )
0 173564 173572 173578 173582 173588 173590 173594 173600 173602 173608 173614 173618 173620 173624 173630 173632 173638 173642 173644 173648 173650 173654 173656 173658 173659 173660 173662 173663 173664 173666 173668 173672 173674 173678 173680 173684 173690 173692 173698 173702 173704 173708 173714 173720 173722 173728 173732 173734 173740 173744 173750 173758 203614

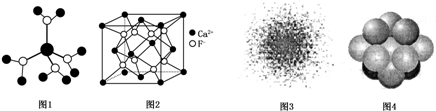
| A. | 水合铜离子的模型如图1所示,1个水合铜离子中有4个配位键 | |
| B. | CaF2晶体的晶胞如图2所示,Ca2+的配位数与F-的配位数之比为1:2 | |
| C. | 氢原子的电子云图如图3所示,表示一段时间内氢原子核外1个电子在空间出现的概率 | |
| D. | 金属Cu中铜原子堆积模型如图4,该金属晶体为面心立方最密堆积 |

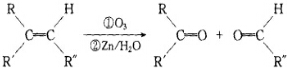
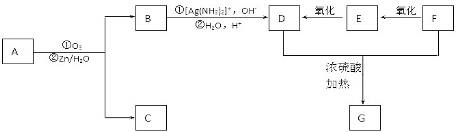
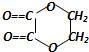 +2H2O,反应类型是酯化反应.D与碳酸氢钠反应的化学方程式是HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2↑+2H2O.
+2H2O,反应类型是酯化反应.D与碳酸氢钠反应的化学方程式是HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2↑+2H2O.