5.用方程式解释下列相应的实验事实正确的是( )
| A. | 稀硫酸与氢氧化钡溶液恰好中和:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | 测得0.1 mol/L氨水中c(OH-)为10-3 mol•L-1:NH3•H2O?NH4++OH- | |
| C. | 在偏铝酸钠溶液中通入过量CO2出现白色沉淀:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| D. | 碳酸氢钠溶液与过量石灰水混合出现白色沉淀:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O |
4.下列各组离子在指定的溶液中能大量共存的是( )
| A. | 无色溶液中:K+、Cu2+、Na+、SO42- | |
| B. | 加入Al能放出H2的溶液中:Cl-、HCO3-、NO3-、NH4+ | |
| C. | 强酸性溶液中:Fe2+、Al3+、NO3-、Cl- | |
| D. | 酚酞试液显红色的溶液中:Ba2+、Na+、AlO2- |
3.下列说法正确的是( )
| A. | 1 L水溶解了0.5 molNaCl,则该溶液的物质的量浓度为0.5 mol•L-1 | |
| B. | 把100g 18.4 mol•L-1的硫酸与等质量的水混合,所得溶液的浓度小于9.2 mol•L-1 | |
| C. | 将 100g10%的盐酸加热蒸发,得到 50 g溶液,其质量分数为20% | |
| D. | 把200mL3 mol•L-1的BaCl2溶液跟100mL3 mol•L-1的KCl溶液混合后,溶液中的c(Cl-)仍然是3 mol•L-1 |
2.等质量的①CH4、②H2、③H2O、④SO2,在标准状况下所占体积由大到小排列的顺序是( )
| A. | ②>①>③>④ | B. | ④>③>①>② | C. | ③>②>④>① | D. | ②>①>④>③ |
1.NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| B. | 标准状况下,2.24 LCO和CO2混合气体中含有的氧原子数为0.15NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| D. | 50ml 18mol/L硫酸与足量铜片共热,转移的电子数为0.9NA |
20.下列叙述正确的是( )
| A. | 提出原子结构模型的科学家按时间先后依次是:道尔顿、卢瑟福、汤姆生、玻尔 | |
| B. | 同温同压下,两种气体的体积不相同,其主要原因是分子间的平均距离不同 | |
| C. | 地球上大量的溴蕴藏在大海中,因此溴被称为“海洋元素” | |
| D. | 胶体与其它分散系的本质区别是胶体有丁达尔效应,而其它分散系却没有 |
17.下列各组物质依次表示a、b、c、d,其中满足如图所示转化关系的是(图中箭头表示一步转化)( )

0 173528 173536 173542 173546 173552 173554 173558 173564 173566 173572 173578 173582 173584 173588 173594 173596 173602 173606 173608 173612 173614 173618 173620 173622 173623 173624 173626 173627 173628 173630 173632 173636 173638 173642 173644 173648 173654 173656 173662 173666 173668 173672 173678 173684 173686 173692 173696 173698 173704 173708 173714 173722 203614

| A. | Si、SiO2、H2SiO3、Na2SiO3 | B. | Fe2O3、Fe、FeCl2、FeCl3 | ||
| C. | Cu、CuO、Cu(OH)2、CuSO4 | D. | Na、Na2O2、NaOH、Na2CO3 |
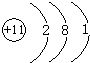 ;
;