题目内容
20.下列叙述正确的是( )| A. | 提出原子结构模型的科学家按时间先后依次是:道尔顿、卢瑟福、汤姆生、玻尔 | |
| B. | 同温同压下,两种气体的体积不相同,其主要原因是分子间的平均距离不同 | |
| C. | 地球上大量的溴蕴藏在大海中,因此溴被称为“海洋元素” | |
| D. | 胶体与其它分散系的本质区别是胶体有丁达尔效应,而其它分散系却没有 |
分析 解:A、提出原子结构模型的科学家按时间先后依次是:道尔顿、汤姆生、卢瑟福、玻尔;
B、同温同压下气体摩尔体积相同,根据V=nVm判断体积不同的原因;
C、地球上99%以上的溴都蕴藏在汪洋大海中;
D、从分散系的本质特征是分散质直径大小分析;
解答 解:A、1803年道尔顿模型 原子是一个坚硬的实心小球;1904年汤姆生(J.J.Thompson)模型 原子是一个带正电荷的球,电子镶嵌在里面,原子好似一块“葡萄干布丁”;1911年卢瑟福提出行星模型:原子的大部分体积是空的,电子按照一定轨道围绕着一个带正电荷的很小的原子核运转;1913年玻尔模型电子不是随意占据在原子核的周围,而是在固定的层面上运动,当电子从一个层面跃迁到另一个层面时,原子便吸收或释放能量,故提出原子结构模型的科学家按时间先后依次是:道尔顿、汤姆生、卢瑟福、玻尔故A错误;
B、对于气体来说,粒子之间的距离远远大于粒子的直径、粒子的质量,同温同压下气体粒子间的距离相等,同温同压下气体摩尔体积相同,由V=nVm=$\frac{N}{{N}_{A}}$Vm知,气体的体积取决于粒子数目的不同,故B错误;
C、地球上99%以上的溴都蕴藏在汪洋大海中,故溴有“海洋元素”的美称,故C正确;
D、胶体与其它分散系的本质区别是分散质微粒的直径大小,故D错误;
故选C.
点评 本题考查了化学与生活中的化学知识分析判断,主要是物质性质的理解应用,掌握基础是关键,题目难度不大.

练习册系列答案
相关题目
10.下列变化过程中,需要加入还原剂才能实现的是( )
| A. | Fe→FeSO4 | B. | SO2→S | C. | CO→CO2 | D. | HCl→Cl2 |
11.已知次氯酸是比碳酸还弱的酸,反应Cl2+H2O?HCl+HClO达到平衡后,要使HClO浓度增大,H+浓度减小,可加入( )
| A. | Na2SO3固体 | B. | 水 | C. | CaCO3固体 | D. | NaOH固体 |
8.下列关于化学反应速率的说法中,表述正确的是( )
| A. | 加入催化剂加快了反应速率,改变了反应吸收或放出的热量 | |
| B. | 对于某可逆反应,反应进行的净速率是正、逆反应速率之差 | |
| C. | 正反应速率越大,反应物的转化率越大 | |
| D. | 压强越大,活化分子百分数越大 |
15.已知微粒的氧化性强弱:Br2>Fe3+>I2>S,判断下列反应不能发生的是( )
| A. | 碘化钾溶液与氯化铁溶液混和 2Fe3++2I-═2Fe2++I2 | |
| B. | 碘化亚铁溶液中滴入少量溴水Br2+2Fe2+═2Fe3++2Br- | |
| C. | 硫化钠溶液中加入足量的溴水Br2+S2-═S↓+2Br- | |
| D. | 硫化钠溶液加入少量氯化铁溶液 3S2-+2Fe3+═S↓+2FeS↓ |
5.用方程式解释下列相应的实验事实正确的是( )
| A. | 稀硫酸与氢氧化钡溶液恰好中和:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | 测得0.1 mol/L氨水中c(OH-)为10-3 mol•L-1:NH3•H2O?NH4++OH- | |
| C. | 在偏铝酸钠溶液中通入过量CO2出现白色沉淀:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| D. | 碳酸氢钠溶液与过量石灰水混合出现白色沉淀:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O |
12.下列叙述中正确的是( )
| A. | ${\;}_{17}^{37}$Cl的中子数为37 | B. | H2O与D2O互称同素异形体 | ||
| C. | NH3的电子式为 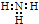 | D. | 1H与D互称同位素 |
9.H2有还原性,可以还原氧化铜,是因为H2中氢元素的化合价处于低价(0价),可以升高至+1价.由此分析:下列化学反应的反应物中的氢元素能体现还原性的是( )
| A. | Mg+2HCl═MgCl2+H2↑ | B. | 2Na2O2+2H2O═4NaOH+O2↑ | ||
| C. | NaH+H2O═NaOH+H2↑ | D. | 2H2O2═2H2O+O2↑ |