6.NA表示阿伏加德罗常数的值,下列叙述不正确的是( )


| A. | CO和N2为等电子体,22.4 L的CO气体与l mol N2所含的电子数相等 | |
| B. | 在2.4 g石墨中,含C-C共价键数目为0.3NA | |
| C. | 720 g C60晶体含有0.25NA个晶胞(晶胞如图) | |
| D. | 1mol[Cu(NH3)4]2+中含配位键4 NA |
4.下列离子方程式书写正确的是( )
| A. | 实验室制Cl2:MnO2+2H++2Cl-═Mn2++Cl2↑+2H2O | |
| B. | 用过量氨水吸收工业尾气中的SO2:2NH3•H2O+SO2=2NH4++SO32-+H2O | |
| C. | 将铝片打磨后置于NaOH溶液中:2Al+2OH-=2AlO2-+H2↑ | |
| D. | 苯酚浊液与纯碱溶液混合后变澄清:2C6H5OH+CO32-=2C6H5O-+CO2↑+H2O |
3.某课外小组探究钠、铝、铁、铜单质还原性强弱及其相关化学性质,做了如表实验:
(1)实验1中能发生反应的离子方程式2Na+2H2O=2Na++2OH-+H2↑.
(2)实验2中能够判断出铝、铁、铜还原性强弱的现象是铝、铁均产生气泡且铝稍快些,铜不产生气泡.
结论:由实验1、2得出四种金属的还原性强弱顺序为Na>Al>Fe>Cu;请从原子结构角度解释钠的还原性强于铝Na、Al同属于第三周期Na原子半径大于Al.
(3)为确认实验2反应后溶液中的金属阳离子,再进行实验:
①取Al反应后的溶液逐滴加入过量的NaOH溶液
②一段时间后,取Fe反应后的溶液,检验Fe2+方法正确的是bc.
a.滴加KSCN溶液,无明显变化,再加入少量氯水,溶液变红
b.滴加K3[Fe(CN)6]溶液,有蓝色沉淀产生
c.滴加NaOH溶液,产生的白色沉淀迅速变成灰绿色,最终变成红褐色
(4)在实验2中,铝、铁反应现象的差异并不是很明显,有同学建议再设计一种实验来证明这两种金属的还原性关系,请设计一种实验方案将铝条插入硫酸亚铁溶液溶液中,溶液颜色变浅,铝条变粗.
(5)在实验过程中,还有同学为了验证铁与铜的还原性,用铁、铜、导线、烧杯、氯化铁溶液设计了原电池装置.
①画出原电池的装置图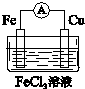 .
.
②该电池的正极反应为2Fe3++2e-=2Fe2+.
| 实验1 | 常温时取四种金属少量分别放入装有蒸馏水的试管中 |
| 实验2 | 再取少量铝、铁、铜分别放入装有稀硫酸的试管中 |
(2)实验2中能够判断出铝、铁、铜还原性强弱的现象是铝、铁均产生气泡且铝稍快些,铜不产生气泡.
结论:由实验1、2得出四种金属的还原性强弱顺序为Na>Al>Fe>Cu;请从原子结构角度解释钠的还原性强于铝Na、Al同属于第三周期Na原子半径大于Al.
(3)为确认实验2反应后溶液中的金属阳离子,再进行实验:
①取Al反应后的溶液逐滴加入过量的NaOH溶液
②一段时间后,取Fe反应后的溶液,检验Fe2+方法正确的是bc.
a.滴加KSCN溶液,无明显变化,再加入少量氯水,溶液变红
b.滴加K3[Fe(CN)6]溶液,有蓝色沉淀产生
c.滴加NaOH溶液,产生的白色沉淀迅速变成灰绿色,最终变成红褐色
(4)在实验2中,铝、铁反应现象的差异并不是很明显,有同学建议再设计一种实验来证明这两种金属的还原性关系,请设计一种实验方案将铝条插入硫酸亚铁溶液溶液中,溶液颜色变浅,铝条变粗.
(5)在实验过程中,还有同学为了验证铁与铜的还原性,用铁、铜、导线、烧杯、氯化铁溶液设计了原电池装置.
①画出原电池的装置图
 .
.②该电池的正极反应为2Fe3++2e-=2Fe2+.
19.在K+浓度为1mol•L-1的某澄清溶液中,还可能含有下表中的若干种离子.(已知H2SiO3为不溶于水的胶状沉淀,加热时易分解为两种氧化物;Ag2CO3是难溶物.)
现取该溶液100mL进行如下实验(气体体积均在标准状况下测定).
请回答下列问题.
(1)实验Ⅰ能确定一定不存在的离子是Ag+、Mg2+、Ba2+;
(2)实验Ⅰ中生成气体的离子方程式为CO32-+2H+=H2O+CO2↑;
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,NO3-是否存在不一定(选填“是”或“不一定”或“否”).
(4)判断Na+是否存在,若存在求其最小浓度存在,其浓度至少为0.3mol/L,若不存在说明理由:-.
| 阳离子 | Na+、Ag+、Ca2+、Ba2+ |
| 阴离子 | NO3-、CO32-、SiO32-、SO42- |
| 序号 | 实验内容 | 实验结果 |
| Ⅰ | 向该溶液中加入足量稀盐酸 | 产生白色胶状沉淀并放出标准状况下0.56L气体 |
| Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4g |
| Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
(1)实验Ⅰ能确定一定不存在的离子是Ag+、Mg2+、Ba2+;
(2)实验Ⅰ中生成气体的离子方程式为CO32-+2H+=H2O+CO2↑;
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,NO3-是否存在不一定(选填“是”或“不一定”或“否”).
(4)判断Na+是否存在,若存在求其最小浓度存在,其浓度至少为0.3mol/L,若不存在说明理由:-.
18.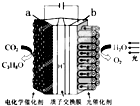 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )| A. | 该装置工作时,b极发生还原反应 | |
| B. | 每生成1molO2,有44gCO2被还原 | |
| C. | 该装置工作时,H+从a极区通过质子交换膜向b极区迁移 | |
| D. | a电极的反应为:3CO2+18H++18e-═C3H8O+5H2O |
17.下列有关实验的与如图所示对应正确的是( )
0 173512 173520 173526 173530 173536 173538 173542 173548 173550 173556 173562 173566 173568 173572 173578 173580 173586 173590 173592 173596 173598 173602 173604 173606 173607 173608 173610 173611 173612 173614 173616 173620 173622 173626 173628 173632 173638 173640 173646 173650 173652 173656 173662 173668 173670 173676 173680 173682 173688 173692 173698 173706 203614
| A. | 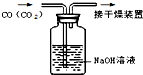 除去CO中的CO2 | |
| B. | 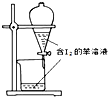 苯萃取碘水中的I2分出水层后的操作 | |
| C. | 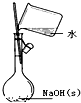 配制0.10mol•L-1 NaOH溶液 | |
| D. | 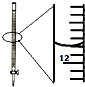 记录滴定终点读数为12.20mL |
 工、农业废水及生活污水中浓度较高的NO${\;}_{3}^{-}$会造成氮污染,工业上处理水体中NO${\;}_{3}^{-}$的一种方法是单质铁化学还原法.某化学小组用废铁屑和硝酸盐溶液模拟此过程,实验如下.
工、农业废水及生活污水中浓度较高的NO${\;}_{3}^{-}$会造成氮污染,工业上处理水体中NO${\;}_{3}^{-}$的一种方法是单质铁化学还原法.某化学小组用废铁屑和硝酸盐溶液模拟此过程,实验如下. 元素X、Y、Z、M、R均为短周期主族元素,且原子序数依次增大.已知Y原子最外层电子数与核外电子总数之比为3:4,M原子的最外层电子数与次外层电子数之比为3:4,且M原子的质子数是Y原子的2倍;R-、Z+、X+离子半径逐渐减小;化合物XR常温下为气体,请回答下列问题:
元素X、Y、Z、M、R均为短周期主族元素,且原子序数依次增大.已知Y原子最外层电子数与核外电子总数之比为3:4,M原子的最外层电子数与次外层电子数之比为3:4,且M原子的质子数是Y原子的2倍;R-、Z+、X+离子半径逐渐减小;化合物XR常温下为气体,请回答下列问题: .
.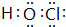 .
.