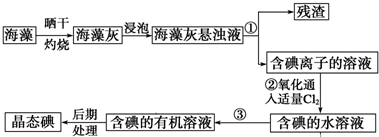
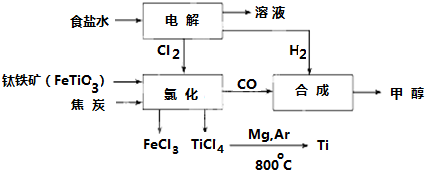
7.某温度下,可逆反应mA(g)+nB(g)?pC(g)的平衡常数为K,下列对K的说法正确的是( )
| A. | K值越大,表明该反应速率越快,反应物的转化率也越大 | |
| B. | 若缩小反应器的容积,能使平衡正向移动,则K增大 | |
| C. | 温度相同,K值也一定相同 | |
| D. | pC(g)?mA(g)+nB(g) 的平衡常数与K互为相反数 |
5.环境污染已严重危害人类的生活.将对应的选项的字母填入下表中
A.氟利昂 B.SO2C.NO2D.CO2
A.氟利昂 B.SO2C.NO2D.CO2
| 环境问题 | 造成环境问题的主要物质 |
| 温室效应 | |
| 酸雨 | |
| 南极臭氧层空洞 | |
| 光化学烟雾 |
20. 镍及其化合物常用作合金、催化剂及电极材料.已知:镍元素有+2、+3价的氧化物和氢氧化物,在盐中以+2价的形式存在.
镍及其化合物常用作合金、催化剂及电极材料.已知:镍元素有+2、+3价的氧化物和氢氧化物,在盐中以+2价的形式存在.
(1)镍与稀硝酸反应放出NO,反应的化学方程式是3Ni+8HNO3=3Ni(NO3)2+2NO↑+4H2O.
(2)Ni2O3是一种重要的电池材料.
①铁镍蓄电池放电时总反应为:Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2
电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2;
电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+6H2O.
②在碱性条件下,镍氢电池的总反应为:3Ni2O3+LaNi5H6+3H2O$?_{充电}^{放电}$LaNi5+6Ni(OH)2,该电池放电时,负极电极反应为LaNi5H6+6OH--6e-=LaNi5+6H2O
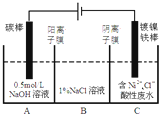
(3)工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示.
已知:
①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
下列说法不正确的是BD
A.碳棒上发生的电极反应:4OH--4e- O2↑+2H2O
B.电解过程中,B室中NaCl溶液的物质的量浓度将不断减少
C.为了提高Ni的产率,电解过程中需要控制废水pH
D.若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式不发生改变
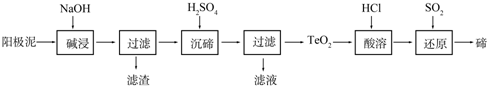
(4)某工厂用废的含镍催化剂(主要含Ni,还含有一定量的Al、Fe、SiO2)回收镍的流程如下:

已知:上述流程中,几种氢氧化物完全沉淀时的pH如下表:
①水合肼(N2H4•H2O)是强还原剂,氧化产物对环境友好.由“沉淀→镍”的化学方程式2Ni(OH)2+N2H4•H2O═2Ni+N2↑+5H2O.
②滤渣b所含成份的化学式为Al(OH)3、Fe(OH)3.
③若将溶液调整为pH=6时加入了bkgNi(OH)2,从酸浸到滤液B的过程中镍的损失率为3%,后几步操作过程中镍的损失率为5%,akg废催化剂(含Ni70%)经上述流程最终得到金属镍的质量为(a×70%×97%+$\frac{59}{93}$b)×95%kg(填计算式).
0 173481 173489 173495 173499 173505 173507 173511 173517 173519 173525 173531 173535 173537 173541 173547 173549 173555 173559 173561 173565 173567 173571 173573 173575 173576 173577 173579 173580 173581 173583 173585 173589 173591 173595 173597 173601 173607 173609 173615 173619 173621 173625 173631 173637 173639 173645 173649 173651 173657 173661 173667 173675 203614
 镍及其化合物常用作合金、催化剂及电极材料.已知:镍元素有+2、+3价的氧化物和氢氧化物,在盐中以+2价的形式存在.
镍及其化合物常用作合金、催化剂及电极材料.已知:镍元素有+2、+3价的氧化物和氢氧化物,在盐中以+2价的形式存在.(1)镍与稀硝酸反应放出NO,反应的化学方程式是3Ni+8HNO3=3Ni(NO3)2+2NO↑+4H2O.
(2)Ni2O3是一种重要的电池材料.
①铁镍蓄电池放电时总反应为:Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2
电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2;
电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+6H2O.
②在碱性条件下,镍氢电池的总反应为:3Ni2O3+LaNi5H6+3H2O$?_{充电}^{放电}$LaNi5+6Ni(OH)2,该电池放电时,负极电极反应为LaNi5H6+6OH--6e-=LaNi5+6H2O
(3)工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示.
已知:
①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
下列说法不正确的是BD
A.碳棒上发生的电极反应:4OH--4e- O2↑+2H2O
B.电解过程中,B室中NaCl溶液的物质的量浓度将不断减少
C.为了提高Ni的产率,电解过程中需要控制废水pH
D.若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式不发生改变
(4)某工厂用废的含镍催化剂(主要含Ni,还含有一定量的Al、Fe、SiO2)回收镍的流程如下:

已知:上述流程中,几种氢氧化物完全沉淀时的pH如下表:
| 沉淀 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 9.2 |
②滤渣b所含成份的化学式为Al(OH)3、Fe(OH)3.
③若将溶液调整为pH=6时加入了bkgNi(OH)2,从酸浸到滤液B的过程中镍的损失率为3%,后几步操作过程中镍的损失率为5%,akg废催化剂(含Ni70%)经上述流程最终得到金属镍的质量为(a×70%×97%+$\frac{59}{93}$b)×95%kg(填计算式).
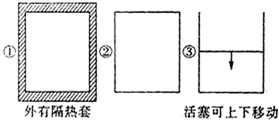 在如图所示的容积相同的三个容器①②③中进行如下反应:3A(g)+B(g)?2C(g)△H<0,若起始温度相同,分别向三个容器中充入6mol A和2mol B,则达到平衡时各容器中C物质的百分含量由大到小的顺序为③②①(填容器编号).
在如图所示的容积相同的三个容器①②③中进行如下反应:3A(g)+B(g)?2C(g)△H<0,若起始温度相同,分别向三个容器中充入6mol A和2mol B,则达到平衡时各容器中C物质的百分含量由大到小的顺序为③②①(填容器编号).