6.2C(s)+O2(g)═2CO(g)△H=-221.0kJ.mol-1这个热化学方程式表示( )
| A. | 2g碳燃烧生成一氧化碳时放出221.0kJ的热量 | |
| B. | 2mol碳燃烧生成一氧化碳时吸收221.0kJ的热量 | |
| C. | 2mol固体碳在氧气中燃烧生成2 mol一氧化碳气体时放出221.0kJ的热量 | |
| D. | 12g碳和氧气反应生成一氧化碳时放出221.0kJ的热量? |
5. X、Y、Z、W四种物质的转化关系如图所示(部分反应物和产物已经省略).下列组合中不符合该关系的是
X、Y、Z、W四种物质的转化关系如图所示(部分反应物和产物已经省略).下列组合中不符合该关系的是
( )
 X、Y、Z、W四种物质的转化关系如图所示(部分反应物和产物已经省略).下列组合中不符合该关系的是
X、Y、Z、W四种物质的转化关系如图所示(部分反应物和产物已经省略).下列组合中不符合该关系的是 | A | B | C | D | |
| X | HCl | Na2O2 | Na2CO3 | Al2O3 |
| Y | FeCl2 | NaOH | CO2 | AlCl3 |
| Z | Cl2 | Na2CO3 | CaCO3 | NaAlO2 |
| W | FeCl3 | NaHCO3 | Ca(HCO3)2 | Al(OH)3 |
| A. | A | B. | B | C. | C | D. | D |
4.已知2SO2+O2═SO3正反应的反应速率是v1,2HI═I2+H2,逆反应的反应速率是v2,对于上述两个反应,当增大压强时,v1,v2的变化情况为( )
| A. | 都减小 | B. | 都增大 | C. | v1减小v2增大 | D. | v1增大v2减小 |
3.由不同种类的原子组成的物质可能是( )
①纯净物
②混合物
③单质
④化合物
⑤金属
⑥非金属
⑦酸
⑧碱
⑨盐
⑩氧化物.
①纯净物
②混合物
③单质
④化合物
⑤金属
⑥非金属
⑦酸
⑧碱
⑨盐
⑩氧化物.
| A. | ①③⑤⑦⑨ | B. | ②④⑧⑩ | C. | ①③ | D. | 全部 |
2.下列有关化学用语表述正确的是( )
| A. | S2-的结构示意图: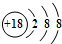 | |
| B. | CO2的比例模型: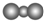 | |
| C. | 邻羟基苯甲酸的结构简式: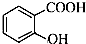 | |
| D. | 质子数为79、中子数为118的金(Au)原子:${\;}_{79}^{118}$Au |
1.向足量稀H2SO4溶液中加入100mL 0.4mol•L-1 Ba(OH)2溶液,放出的热量是5.12kJ.如果向足量Ba(OH)2溶液中加入100mL 0.4mol•L-1 HCl溶液时,放出的热量为2.2kJ.则Na2SO4溶液与BaCl2溶液反应的热化学方程式为( )
| A. | Ba2+(aq)+SO${\;}_{4}^{2-}$(aq)═BaSO4(s)△H=-2.92 kJ•mol-1 | |
| B. | Ba2+(aq)+SO${\;}_{4}^{2-}$(aq)═BaSO4(s)△H=-0.72 kJ•mol-1 | |
| C. | Ba2+(aq)+SO${\;}_{4}^{2-}$(aq)═BaSO4(s)△H=-73 kJ•mol-1 | |
| D. | Ba2+(aq)+SO${\;}_{4}^{2-}$(aq)═BaSO4(s)△H=-18 kJ•mol-1 |
20.下列制取蒸馏水的实验装置与操作的说法中,不正确的是( )
| A. | 可用过滤的方法制取蒸馏水 | |
| B. | 冷凝器中的水流方向是从下口进入,上口排出 | |
| C. | 实验中需要在蒸馏烧瓶中加入几片碎瓷片或沸石 | |
| D. | 给蒸馏烧瓶加热时要垫上石棉网 |
17.下列方程式书写正确的是( )
0 173411 173419 173425 173429 173435 173437 173441 173447 173449 173455 173461 173465 173467 173471 173477 173479 173485 173489 173491 173495 173497 173501 173503 173505 173506 173507 173509 173510 173511 173513 173515 173519 173521 173525 173527 173531 173537 173539 173545 173549 173551 173555 173561 173567 173569 173575 173579 173581 173587 173591 173597 173605 203614
| A. | 苏打溶液中加入过量石灰水:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| B. | 用硫酸酸化的橙色的重铬酸钾(K2Cr2O7)溶液与乙醇作用生成乙酸和草绿色三价铬,可以用于检测是否酒后驾驶:2Cr2O72-+3C2H5OH+16H+→4Cr3++3CH3COOH+11H2O | |
| C. | 用铜为电极电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- | |
| D. | 表示乙醇燃烧热的热化学方程式(△H的绝对值正确):C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H=-1367.0kJ•mol-1 |
 W、X、Y、Z四种短周期元素在周期表中的位置如图1所示,其中Y与钠元素和氢元素均可形成原子个数1:1和1:2的化合物.
W、X、Y、Z四种短周期元素在周期表中的位置如图1所示,其中Y与钠元素和氢元素均可形成原子个数1:1和1:2的化合物.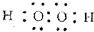 ,Z在周期表中的位置第三周期ⅦA族.
,Z在周期表中的位置第三周期ⅦA族.