题目内容
19.甲醇又称“木醇”,是无色有酒精气味易挥发的有毒液体.甲醇是重要的化学工业基础原料和液体燃料,可用于制造甲醛和农药,并常用作有机物的萃取剂和酒精的变性剂等.(1)工业上可利用CO2和H2生产甲醇,方程式如下:
CO2(g)+3H2(g)?CH3OH(l)+H2O (g)△H=Q1kJ•mol-1
又查资料得知:①CH3OH(l)+$\frac{1}{2}$O2(g)?CO2(g)+2H2(g)△H=Q2kJ•mol-1
②H2O(g)=H2O(l)△H=Q3kJ•mol-1,则表示甲醇的燃烧热的热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=(2Q1+3Q2+2Q3)kJ•mol-1.
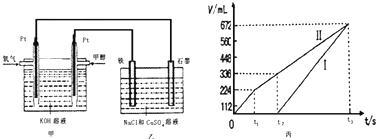
某同学设计了一个甲醇燃料电池,并用该电池电解200mL一定浓度的NaCl与CuSO4混合溶液,其装置如图:
(2)为除去饱和食盐水中的铵根离子,可在碱性条件下通入氯气,反应生成氮气.该反应的离子方程式为3Cl2+2NH4++8OH-=N2↑+6Cl-+8H2O.
(3)过量氯气用Na2S2O3除去,反应中S2O32-被氧化为SO42-.若过量的氯气为1×10-3mol,则理论上生成的SO42-为5×10-4mol.
(4)写出甲中通入甲醇这一极的电极反应式CH3OH-6e-+8OH-=CO32-+6H2O.
(5)理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式4OH--4e-=O2↑+2H2O,原混合溶液中 NaCl的物质的量浓度为0.1mol/L.(设溶液体积不变)
(6)当向上述甲装置中通入标况下的氧气336mL时,理论上在铁电极上可析出铜的质量为1.28g.
(7)若使上述电解装置的电流强度达到5.0A,理论上每分钟应向负极通入气体的质量为0.017克.(已知1个电子所带电量为1.6×10-19C,计算结果保留两位有效数字)
分析 (1)依据热化学方程式和盖斯定律计算分析得到所需热化学方程式;
(2)可以根据反应物和生成物正确书写化学方程式;
(3)依据离子方程式的定量关系计算生成硫酸根离子的量;
(4)在燃料电池的中,负极上是燃料发生失电子的氧化反应,根据电解质环境来书写电极反应式;
(5)根据电解池的电极反应规律来书写电解反应,结合电子守恒和离子的量的关系进行计算;
(6)根据n=$\frac{V}{{V}_{m}}$计算出氧气的物质的量,再根据丙中图象判断铜离子的总物质的量,最后根据m=nM计算出生成铜的质量;
(7)根据Q=It和N=$\frac{Q}{e}$结合CH3OH-6e-+8OH-=CO32-+6H2O计算.
解答 解:(1)①CO2(g)+3H2(g)?CH3OH(l)+H2O (g)△H=Q1kJ•mol-1
②CH3OH(l)+$\frac{1}{2}$O2(g)?CO2(g)+2H2(g)△H=Q2kJ•mol-1
③H2O(g)=H2O(l)△H=Q3kJ•mol-1,依据盖斯定律①×2+②×3+③×2得到:
表示甲醇的燃烧热的热化学方程式为:CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=(2Q1+3Q2+2Q3) kJ•mol-1;
故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=(2Q1+3Q2+2Q3) kJ•mol-1;
(2)电解后的碱性溶液是氢氧化钠溶液,生成物是氮气、氯化钠、水.反应的离子方程式为:3Cl2+2NH4++8OH-═N2↑+6Cl-+8H2O,
故答案为:3Cl2+2NH4++8OH-=N2↑+6Cl-+8H2O;
(3)过量氯气用Na2S2O3除去,反应中S2O32-被氧化为SO42-.反应的离子方程式为:4Cl2+5H2O+S2O32-═2SO42-+8Cl-+10H+;若过量的氯气为10-3mol/L,则依据离子方程式的定量关系计算得到生成硫酸根离子物质的量=5×10-4mol/L,
故答案为:5×10-4;
(4))在燃料电池的中,负极上是燃料发生失电子的氧化反应,在碱性环境下,甲醇失电子的过程为:CH3OH-6e-+8OH-=CO32-+6H2O,
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
(5)石墨为阳极、铁电极为阴极,开始Cl-在阳极放电生成氯气,阴极Cu2+放电生成Cu,故图丙中Ⅰ表示阴极产生的气体,Ⅱ表示阳极产生的气体,t1前电极反应式为:阳极2Cl--4e-=Cl2↑,t2点后电极反应式为:阳极4OH--4e-=O2↑+2H2O,
由图可知,产生氯气为224mL,则由2Cl--2e-=Cl2↑可知,n(NaCl)=$\frac{0.224L}{22.4L/mol}$×2=0.02mol,所以c(NaCl)=$\frac{0.02mol}{0.2L}$=0.1mol/L,
通甲醇的电极是负极,所以石墨电极是阴极,该极上发生的电极反应为:4OH--4e-=O2↑+2H2O,乙中石墨电极为阳极、铁电极为阴极,开始Cl-在阳极放电生成氯气,阴极Cu2+放电生成Cu,故图丙中Ⅰ表示阴极产生的气体,Ⅱ表示阳极产生的气体,t1前电极反应式为:阳极2Cl--4e-=Cl2↑,生成氯气为224ml,物质的量为0.01mol,原溶液中氯化钠物质的量为0.02mol,氯化钠浓度为:$\frac{0.02mol}{0.2L}$=0.1mol/L,
故答案为:4OH--4e-=O2↑+2H2O;0.1;
(6)标准状况下336mL氧气的物质的量为:$\frac{0.336L}{22.4L/mol}$=0.015mol,0.015mol氧气完全反应得到电子的物质的量为:0.015mol×4=0.06mol,
由丙中t2时生成氧气为112mL,则生成氧气的物质的量为:n(O2)=$\frac{0.112L}{22.4L/mol}$=0.005mol,则共转移电子为:0.02mol+0.005mol×4=0.04mol,
根据电子守恒及Cu2++2e-=Cu可知,n(CuSO4)=$\frac{0.04mol}{2}$=0.02mol,
所以理论上在铁电极上可析出铜的物质的量为0.02mol,质量为:64g/mol×0.02mol=1.28g,
故答案为:1.28;
(7)根据Q=It=5.0A×60s=300C,N=$\frac{Q}{e}$=$\frac{300}{1.6×1{0}^{-19}}$=1.875×1021个,
由CH3OH~6e-
32g 6×6.02×1023个
m 1.875×1021个
m=$\frac{32g×1.875×1{0}^{21}}{6×6.02×1{0}^{23}}$=0.017g,
故答案为:0.017.
点评 本题考查了盖斯定律的应用、原电池和电解池工作原理,题目难度较大,注意掌握盖斯定律的含义及应用方法,明确原电池、电解池工作原理为解答关键,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及灵活应用能力.

 名校课堂系列答案
名校课堂系列答案| A. | 空气 | B. | 漂白粉 | C. | 氧化铝 | D. | 镁铝合金 |
| A. | 阴极发生还原反应,电极反应式包括:Cu2++2e-═Cu,Ni2++2e-═Ni | |
| B. | 电解过程中,阳极减少的质量可能等于阴极增加的质量 | |
| C. | 电解后,电解槽底部的阳极泥中含有Cu、Pb和Pt | |
| D. | 若不考虑阳离子的水解,则电解过程中电解质溶液中的金属阳离子的总数目不变 |
①MgSO4溶液 ②AlCl3溶液 ③稀H2SO4④饱和澄清石灰水 ⑤Ca(HCO3)2溶液 ⑥CuSO4溶液 ⑦氯化铵液.
| A. | ①②③⑦ | B. | ③⑤⑥⑦ | C. | ②③④⑥ | D. | ①④⑤⑥ |
| A. | 不慎将浓碱液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液 | |
| B. | 制备氢氧化铁胶体时,应向沸水中逐滴滴加1~2 mL饱和的FeC13溶液,并继续加热到液体呈透明的红褐色为止 | |
| C. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| D. | 将固体加入容量瓶中溶解并稀释至刻度线,配制成一定物质的量浓度的溶液 |
| A. | 都减小 | B. | 都增大 | C. | v1减小v2增大 | D. | v1增大v2减小 |
| A. | 热的浓盐酸可以除去烧瓶内残留的MnO2 | |
| B. | 过量的铜与浓硝酸反应会有一氧化氮生成 | |
| C. | 稀硝酸可除去试管内壁的银镜 | |
| D. | 白磷在空气中加热到一定温度能转化成红磷 |
| A. | 过滤 | B. | 分液 | C. | 萃取 | D. | 蒸馏 |