题目内容
18. W、X、Y、Z四种短周期元素在周期表中的位置如图1所示,其中Y与钠元素和氢元素均可形成原子个数1:1和1:2的化合物.
W、X、Y、Z四种短周期元素在周期表中的位置如图1所示,其中Y与钠元素和氢元素均可形成原子个数1:1和1:2的化合物.请回答下列问题.
(1)H2Y2的电子式为
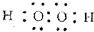 ,Z在周期表中的位置第三周期ⅦA族.
,Z在周期表中的位置第三周期ⅦA族.(2)在如图2中,b的pH约为7,且含有Fe2+和淀粉KI的水溶液,a为H2Y2的水溶液,旋开分液漏斗旋钮,观察到烧瓶中溶液呈蓝色并有红褐色沉淀生成.当消耗2molI-时,共转移3mol电子,该反应的离子方程式是2Fe2++3H2O2+4I-=2Fe(OH)3↓+2I2.
(3)已知:298K时,金属钠与Y2气体反应,若生成1molNa2Y固体时,放出热量414kJ;若生成1molNa2Y2固体时,放出热量511kJ.则由Na2Y固体与Y2气体反应生成Na2Y2固体的热化学方程式为Na2O(s)+$\frac{1}{2}$O2(g)=Na2O2(s)△H=-97kJ/mol.
(4)有人设想利用原电池原理以气体Z2和氢气制备一种重要的化工原料,同时获取电能.假设这种想法可行,用石墨作电极材料,用稀盐酸作电解溶液,则通入Z2的电极为原电池的正极,其电极反应式为Cl2+2e-=2Cl-.
分析 W、X、Y、Z四种短周期元素,由元素在元素周期表中的位置,可知W、Y处于第二周期,X、Z处于第三周期,其中Y与钠元素和氢元素均可形成原子个数l:1和1:2的化合物,则Y为O元素,可推知W为C元素、X为P、Z为Cl.
(1)H2O2分子中O原子之间形成1对共用电子对、H原子与O原子之间形成1对共用电子对;主族元素周期数=电子层数、主族族序数=最外层电子数;
(2)在图2中,将H2O2的水溶液滴入含有Fe2+和淀粉KI的水溶液,观察到烧瓶中溶液呈蓝色并有红褐色沉淀生成,说明反应生成氢氧化铁与碘单质.当消耗2molI-时,共转移3mol电子,则参加反应的Fe2+物质的量为$\frac{3mol-2mol}{3-2}$=1mol,参加反应H2O2的物质的量=$\frac{3mol}{2×[(-1)-(-2)]}$=1.5mol,故Fe2+、H2O2、I-的化学计量数之比=2:3:4,据此书写;
(3)由题意可知:①2Na(s)+$\frac{1}{2}$O2(g)=Na2O(s)△H=-414kJ/mol
②2Na(s)+O2(g)=Na2O2(s)△H=-511kJ/mol
根据盖斯定律,②-①得Na2O(s)+$\frac{1}{2}$O2(g)=Na2O2(s);
(4)氯气获得电子生成Cl-,发生还原反应,应在原电池正极通入.
解答 解:W、X、Y、Z四种短周期元素,由元素在元素周期表中的位置,可知W、Y处于第二周期,X、Z处于第三周期,其中Y与钠元素和氢元素均可形成原子个数l:1和1:2的化合物,则Y为O元素,可推知W为C元素、X为P、Z为Cl.
(1)H2O2分子中O原子之间形成1对共用电子对、H原子与O原子之间形成1对共用电子对,其电子式为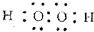 ;Z为Cl元素,处于第三周期ⅦA族,
;Z为Cl元素,处于第三周期ⅦA族,
故答案为: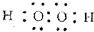 ;第三周期ⅦA族;
;第三周期ⅦA族;
(2)在图2中,将H2O2的水溶液滴入含有Fe2+和淀粉KI的水溶液,观察到烧瓶中溶液呈蓝色并有红褐色沉淀生成,说明反应生成氢氧化铁与碘单质.当消耗2molI-时,共转移3mol电子,则参加反应的Fe2+物质的量为$\frac{3mol-2mol}{3-2}$=1mol,参加反应H2O2的物质的量=$\frac{3mol}{2×[(-1)-(-2)]}$=1.5mol,故Fe2+、H2O2、I-的化学计量数之比=2:3:4,该反应离子方程式为:2Fe2++3H2O2+4I-=2Fe(OH)3↓+2I2,
故答案为:2Fe2++3H2O2+4I-=2Fe(OH)3↓+2I2;
(3)根据题意可知:①2Na(s)+$\frac{1}{2}$O2(g)=Na2O(s)△H=-414kJ/mol
②2Na(s)+O2(g)=Na2O2(s)△H=-511kJ/mol
根据盖斯定律,②-①得Na2O(s)+$\frac{1}{2}$O2(g)=Na2O2(s)△H=-97kJ/mol,
故答案为:Na2O(s)+$\frac{1}{2}$O2(g)=Na2O2(s)△H=-97kJ/mol;
(4)氯气获得电子生成Cl-,发生还原反应,应在原电池正极通入,电极反应式为:Cl2+2e-=2Cl-,
故答案为:正;Cl2+2e-=2Cl-.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,(3)中离子方程式书写注意根据电子转移计算确定化学计量数.

 名校课堂系列答案
名校课堂系列答案| A. | σ键是由两个p电子“肩并肩”重叠形成的 | |
| B. | σ键和π键都是共价键,σ键比π键更稳定 | |
| C. | 乙烯分子中的 和乙炔分子中的-C≡C-都是π键 和乙炔分子中的-C≡C-都是π键 | |
| D. | H2分子中含有σ键,HCl分子中含π键 |
| A. | 都具有吸水性 | |
| B. | 露置于空气中都能形成白雾 | |
| C. | 露置于空气中,溶液浓度均降低 | |
| D. | 在空气中长期露置,溶液质量均减轻 |
①纯净物
②混合物
③单质
④化合物
⑤金属
⑥非金属
⑦酸
⑧碱
⑨盐
⑩氧化物.
| A. | ①③⑤⑦⑨ | B. | ②④⑧⑩ | C. | ①③ | D. | 全部 |
| A. | 实验剩余的药品不能放回原试剂瓶 | |
| B. | 酒精灯内酒精不能多于酒精灯容积的2/3 | |
| C. | 实验结束后将试管清洗干净 | |
| D. | 胶头滴管不能交叉使用 |
| A. | 煤矸石中的金属氧化物均溶于水,且都能与水反应 | |
| B. | 煤矸石含有的酸性氧化物对应的水化物中,酸性最强的是H3PO4 | |
| C. | 煤矸石可用于生产矸石水泥、耐火砖等建筑材料 | |
| D. | 用盐酸可以溶解煤矸石中的所有氧化物 |