3.下列热化学方程式正确的是( )
| A. | 甲烷的标准燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa 下,将0.5 mol N2 和 1.5 mol H2 置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)$?_{500℃、30MPa}^{催化剂}$ 2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | 已知在120℃、101 kPa下,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为 H2(g)+$\frac{1}{2}$O2(g)$\frac{\underline{\;\;\;120℃\;\;\;}}{101KPa}$H2O(g)△H=-242 kJ/mol | |
| D. | 25℃,101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,硫酸溶液与氢氧化钾溶液反应的热化学方程式为H2SO4(aq)+2KOH(aq)═K2SO4(aq)+2H2O(l)△H=-57.3 kJ/mol |
2.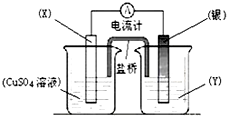 已知反应Cu(s)+2Ag+ (aq)═Cu2+(aq)+2Ag(s)为一自发进行的氧化还原反应,将其设计成如图所示原电池.下列说法中正确的是( )
已知反应Cu(s)+2Ag+ (aq)═Cu2+(aq)+2Ag(s)为一自发进行的氧化还原反应,将其设计成如图所示原电池.下列说法中正确的是( )
 已知反应Cu(s)+2Ag+ (aq)═Cu2+(aq)+2Ag(s)为一自发进行的氧化还原反应,将其设计成如图所示原电池.下列说法中正确的是( )
已知反应Cu(s)+2Ag+ (aq)═Cu2+(aq)+2Ag(s)为一自发进行的氧化还原反应,将其设计成如图所示原电池.下列说法中正确的是( )| A. | 银电极质量逐渐减小,Y溶液中c(Ag+)增大 | |
| B. | 实验过程中取出盐桥,原电池仍继续工作 | |
| C. | 电极X是正极,其电极反应为Cu-2e-═Cu2+ | |
| D. | 当X电极质量减少0.64g时,外电路中有0.02mol电子转移 |
1.原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关.下列说法中正确的是( )


| A. | ①②中Mg作负极,③④中Fe作负极 | |
| B. | ②中Mg作正极,电极反应式为:2H2O+2e-═2OH-+H2↑ | |
| C. | ③中Fe作负极,电极反应式为Fe-2e-═Fe2+ | |
| D. | ④中Cu作正极,电极反应式为2H++2e-═H2↑ |
20.如图装置能构成原电池的是( )
| A. | 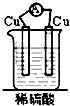 | B. | 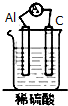 | C. | 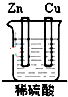 | D. | 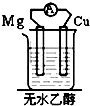 |
19.下列有关氧族元素的叙述中,正确的是( )
| A. | 都能生成+6价化合物 | B. | 原子的最外层电子数都是6 | ||
| C. | 都能生成稳定的氢化物 | D. | 单质在通常情况下均为固体 |
17.下列试剂可将己烯、甲苯、溴苯、NaOH溶液分开的是( )
| A. | 盐酸 | B. | 酸性高锰酸钾 | C. | 溴水 | D. | 石蕊试液 |
16.化学方程式正确的是( )
| A. | CH3CH═CH2+Br2(水溶液)-→CH2BrCH═CH2+HBr | |
| B. | nCH3CH═CH2$\stackrel{一定条件下}{→}$[CH3-CH-CH2]n | |
| C. | CH2═CH-CH═CH2+Br2-→CH2Br2-CH═CH-CH3 | |
| D. | CH3CH2OH$\stackrel{浓H_{2}SO_{4}}{→}$CH2═CH2↑+H2O |
15.下列物质的化学用语表达正确的是( )
| A. | (CH3)3COH的名称:2,2二甲基乙醇 | B. | 甲烷的球棍模型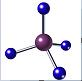 | ||
| C. | 乙醛的结构式:CH3CHO | D. | 四氯化碳分子的电子式: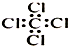 |
14.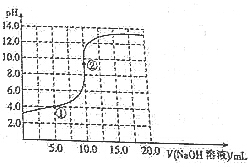 常温下,用0.1mol•L-1的NaOH溶液滴定10.0mL0.1mol•L-1的HA溶液,其滴定曲线如图所示,下列说法不正确的是( )
常温下,用0.1mol•L-1的NaOH溶液滴定10.0mL0.1mol•L-1的HA溶液,其滴定曲线如图所示,下列说法不正确的是( )
0 173313 173321 173327 173331 173337 173339 173343 173349 173351 173357 173363 173367 173369 173373 173379 173381 173387 173391 173393 173397 173399 173403 173405 173407 173408 173409 173411 173412 173413 173415 173417 173421 173423 173427 173429 173433 173439 173441 173447 173451 173453 173457 173463 173469 173471 173477 173481 173483 173489 173493 173499 173507 203614
 常温下,用0.1mol•L-1的NaOH溶液滴定10.0mL0.1mol•L-1的HA溶液,其滴定曲线如图所示,下列说法不正确的是( )
常温下,用0.1mol•L-1的NaOH溶液滴定10.0mL0.1mol•L-1的HA溶液,其滴定曲线如图所示,下列说法不正确的是( )| A. | HA是弱酸 | B. | ②处:c(H+)>c(OH-) | ||
| C. | ①处:c(Na+)=c(A-)+c(HA) | D. | ②处:c(Na+)=c(A-)+c(HA) |