题目内容
16.化学方程式正确的是( )| A. | CH3CH═CH2+Br2(水溶液)-→CH2BrCH═CH2+HBr | |
| B. | nCH3CH═CH2$\stackrel{一定条件下}{→}$[CH3-CH-CH2]n | |
| C. | CH2═CH-CH═CH2+Br2-→CH2Br2-CH═CH-CH3 | |
| D. | CH3CH2OH$\stackrel{浓H_{2}SO_{4}}{→}$CH2═CH2↑+H2O |
分析 A.二者发生加成反应;
B.丙烯发生加聚反应生成聚丙烯;
C.1mol1,3-丁二烯与1mol溴发生1,4加成或者1,2加成;
D.乙醇在浓硫酸做催化剂脱水剂条件下生成乙烯和水.
解答 解:A.CH3CH═CH2+Br2(水溶液)-→CH2BrCH-CH2Br,故A错误;
B. ,故B错误;
,故B错误;
C.二者发生1,4加成反应的方程式:CH2═CH-CH═CH2+Br2-→CH2Br-CH═CH-CH2Br,故C错误;
D.乙醇在浓硫酸做催化剂脱水剂条件下生成乙烯和水,化学方程式:CH3CH2OH$\stackrel{浓H_{2}SO_{4}}{→}$CH2═CH2↑+H2O,故D正确;
故选:D.
点评 本题考查了化学方程式的书写,侧重考查有机反应方程式书写,明确有机物结构及性质是解题关键,注意二烯烃加成的特点,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.常温下甲、乙两醋酸溶液,测得甲的pH=a,乙的pH=a+1,下列推断中正确的是( )
| A. | 甲中由水电离产生的H+的物质的量浓度是乙的10倍 | |
| B. | 物质的量浓度c(甲)=10c(乙) | |
| C. | 中和等物质的量的NaOH溶液,需甲、乙两酸的体积V(乙)>10V (甲) | |
| D. | 甲中的c(OH-)为乙中的c(OH-)的10倍 |
11.某温度下,H2(g)+CO2 (g)?H2O(g)+CO(g)的平衡常数K=$\frac{9}{4}$,该温度下在甲、乙、丙三个恒容密闭容器中,投入H2 (g)和CO2 (g),其起始浓度如表所示,下列判断不正确的是( )
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol•L-1 | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol•L-1 | 0.010 | 0.010 | 0.020 |
| A. | 平衡时,乙中CO2的转化率大于60% | |
| B. | 平衡时,甲中和丙中H2的转化率均是60% | |
| C. | 平衡时,丙中c(CO2)是甲中的2倍,是0.008 mol•L-1 | |
| D. | 反应开始时,乙中的反应速率最快,甲中的反应速率最慢 |
1.原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关.下列说法中正确的是( )


| A. | ①②中Mg作负极,③④中Fe作负极 | |
| B. | ②中Mg作正极,电极反应式为:2H2O+2e-═2OH-+H2↑ | |
| C. | ③中Fe作负极,电极反应式为Fe-2e-═Fe2+ | |
| D. | ④中Cu作正极,电极反应式为2H++2e-═H2↑ |
8.一定条件下下列变化不可能通过一步反应实现的是( )
| A. | Na2CO3→Na2SiO3 | B. | Si→SiO2 | C. | SiO2→H2SiO3 | D. | CuSO4→CuCl2 |
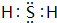 ,1molC的氢化物与足量的C的氧化物反应,转移的电子的物质的量为2mol
,1molC的氢化物与足量的C的氧化物反应,转移的电子的物质的量为2mol 以天然气为原料合成甲醇常见的方法有水煤气法和目前正在开发的直接氧化法
以天然气为原料合成甲醇常见的方法有水煤气法和目前正在开发的直接氧化法