题目内容
20.如图装置能构成原电池的是( )| A. | 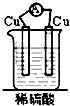 | B. | 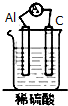 | C. | 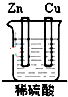 | D. | 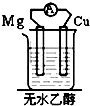 |
分析 根据原电池的构成条件分析,原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应.
解答 解:A、两个活泼性相同的电极,所以不能构成原电池,故A错误;
B、该装置符合原电池的构成条件,所以能形成原电池,故B正确;
C、该装置不能构成闭合回路,所以不能构成原电池,故C错误;
D、酒精不是电解质,不能自发的进行氧化还原反应,所以不能构成原电池,故D错误;
故选B.
点评 本题考查了原电池的构成条件,难度不大,注意这几个条件必须同时存在才能形成原电池,缺一不可.

练习册系列答案
相关题目
11.下列离子方程式书写正确的是( )
| A. | 硫酸亚铁溶液中加过氧化氢溶液 Fe2++2H2O2+4H+═Fe3++4H2O | |
| B. | NaHSO4溶液与Ba(OH)2溶液混合后显酸性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| C. | NaHCO3溶液中加入足量NaHSO4溶液:2H++CO32-═CO2↑+H2O | |
| D. | 氯化亚铁溶液中加入稀硝酸 3Fe2++4H++NO3-═3Fe3++2H2O+NO↑ |
8.金刚石和石墨是碳元素的两种结构不同的单质.在100kPa,1mol石墨转化成金刚石需要吸热1.895kJ.据此,试判断在100kPa压强下,下列结论正确的是( )
| A. | 金刚石比石墨稳定 | B. | 1mol石墨比lmol金刚石总能量高 | ||
| C. | 石墨转化为金刚石属于化学变化 | D. | 石墨和金刚石是碳元素的同位素 |
15.下列物质的化学用语表达正确的是( )
| A. | (CH3)3COH的名称:2,2二甲基乙醇 | B. | 甲烷的球棍模型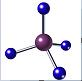 | ||
| C. | 乙醛的结构式:CH3CHO | D. | 四氯化碳分子的电子式: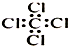 |
12.设NA表示阿伏加德罗常数.下列说法不正确的是( )
| A. | 质量均为mg的H2SO4和H3PO4中含有的电子数均为50mNA/98 | |
| B. | 标准状况下,1升辛烷完全燃烧后,所生成气态产物的分子数为8NA/22.4个 | |
| C. | 在1L0.5mol•L-1的Na2CO3溶液中,离子总数一定大于1.5NA个 | |
| D. | 1mol H2O2与MnO2充分作用下转移的电子总数为NA个 |
8.恒温恒容下,向2L密闭容器中加入MgSO4(s)和CO(g),发生反应:
MgSO4(s)+CO(g)?MgO(s)+CO2(g)+SO2(g)反应过程中测定的部分数据见表:
下列说法正确的是( )
MgSO4(s)+CO(g)?MgO(s)+CO2(g)+SO2(g)反应过程中测定的部分数据见表:
| 反应时间/min | n(MgSO4)/mol | n(CO)/mol | n(CO2)/mol |
| 0 | 2.00 | 2.00 | 0 |
| 2 | 0.80 | ||
| 4 | 1.20 |
| A. | 反应在0~2min内的平均速率为v(SO2)=0.6 mol•L-1•min-1 | |
| B. | 反应在2~4min内容器内气体的密度没有变化 | |
| C. | 若升高温度,反应的平衡常数变为1.00,则正反应为放热反应 | |
| D. | 保持其他条件不变,起始时向容器中充入1.00mol MgSO4和1.00molCO,到达平衡时n(CO2)>0.60mol |
 X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素常见单质在常温下都是无色气体,在适当条件下可发生如图所示变化:
X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素常见单质在常温下都是无色气体,在适当条件下可发生如图所示变化: .
.