3.下列关于热化学反应的描述中正确的是( )
| A. | HCl 和 NaOH 反应的中和热△H=-57.3 kJ/mol,则浓 H2SO4和 Ca(OH)2反应的中和热 △H=2×(-57.3)kJ/mol | |
| B. | CO(g)的燃烧热是 283.0 kJ/mol,则 2CO2(g)═2CO(g)+O2(g)反应的△H=2×283.0 kJ/mol | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏大 |
2.已知一定条件下断裂1mol下列化学键生成气态原子需要吸收的能量如下:H-H 436kJ;Cl-Cl 243kJ;H-Cl 431kJ.下列所得热化学方程式或结论正确的是( )
| A. | H(g)+Cl(g)═HCl(g)△H=-431kJ•mol-1 | |
| B. | 2HCl(g)═H2(g)+Cl2(g)的反应热△H<0 | |
| C. | H2(g)+Cl2(g)═2HCl(g)△H=-183kJ | |
| D. | 相同条件下,H2(g)+Cl2(g)═2HCl(g)反应在光照和点燃条件下的△H不相等 |
1.相同温度下,两个恒压密闭容器中发生可逆反应X2(g)+3Y2(g)?2XY3(g)△H=-92.6kJ•mol-1实验测得反应在起始及达到平衡时的有关数据如表所示:
下列叙述正确的是( )
| 容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量变化 | ||
| X2 | Y2 | XY3 | ||
| ① | 0.1 | 0.3 | 0 | 4.63kJ |
| ② | 0.8 | 2.4 | 0.4 | Q(Q>0)kJ |
| A. | 反应的平衡常数:①>② | |
| B. | 达平衡时,两个容器中XY3的物质的量浓度均为2mol•L-1 | |
| C. | 达到平衡时,容器①、②中各物质的百分含量相同 | |
| D. | 若容器①体积为0.20L,则达平衡时放出的热量大于4.63kJ |
16.目前,消除氮氧化物污染有多种方法.
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染.已知:
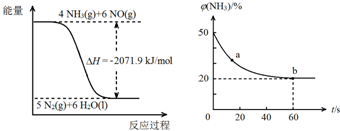
①CH4 (g)+4NO2 (g)=4NO(g)+CO2 (g)+2H2 O(g)△H=-574kJ•mol-1
②CH4 (g)+4NO(g)=2N2 (g)+CO2 (g)+2H2 O(g)△H=-1160kJ•mol-1
③H2O(g)=H2O(l)△H=-44.0kJ•mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955kJ•mol-1
(2)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)?N2 (g)+CO2 (g)某研究小组向恒容密闭容器加入一定的活性炭和NO,恒温条件下反应,反应进行到不同时间测得各物质的浓度如下
①不能作为判断反应达到化学平衡状态的依据是BC
A.容器内CO2的浓度保持不变 B.v正(N2)=2v正(NO)
C.容器内压强保持不变 D.混合气体的密度保持不变
E.混合气体的平均相对分子质量保持不变
②在该温度下时.该反应的平衡常数为0.56(保留两位小数);
③在30min,改变某一条件,反应重新达到平衡,则改变的条件是减小二氧化碳浓度.
(3)合成塔失去活性的铬锌触媒可用于制备锌锰电池.在碱性条件下,该电池的总反应为:
Zn(s)+2MnO2 (s)+H2O(l)=Zn(OH)2 (s)+Mn2O3(s),该电池正极的电极反应式是2MnO2+2e-+H2O=2OH-+Mn2O3.PbO2 可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取.阳极发生反应的电极反应式为Pb2++2H2O-2e-=PbO2+4H+,阴极上观察到的现象是;石墨上红色物质析出若电解液中不加入Cu(NO3)2这样做的主要缺点是Pb将在阴极析出,Pb2+不能得到有效应用.
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染.已知:
①CH4 (g)+4NO2 (g)=4NO(g)+CO2 (g)+2H2 O(g)△H=-574kJ•mol-1
②CH4 (g)+4NO(g)=2N2 (g)+CO2 (g)+2H2 O(g)△H=-1160kJ•mol-1
③H2O(g)=H2O(l)△H=-44.0kJ•mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955kJ•mol-1
(2)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)?N2 (g)+CO2 (g)某研究小组向恒容密闭容器加入一定的活性炭和NO,恒温条件下反应,反应进行到不同时间测得各物质的浓度如下
 | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
A.容器内CO2的浓度保持不变 B.v正(N2)=2v正(NO)
C.容器内压强保持不变 D.混合气体的密度保持不变
E.混合气体的平均相对分子质量保持不变
②在该温度下时.该反应的平衡常数为0.56(保留两位小数);
③在30min,改变某一条件,反应重新达到平衡,则改变的条件是减小二氧化碳浓度.
(3)合成塔失去活性的铬锌触媒可用于制备锌锰电池.在碱性条件下,该电池的总反应为:
Zn(s)+2MnO2 (s)+H2O(l)=Zn(OH)2 (s)+Mn2O3(s),该电池正极的电极反应式是2MnO2+2e-+H2O=2OH-+Mn2O3.PbO2 可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取.阳极发生反应的电极反应式为Pb2++2H2O-2e-=PbO2+4H+,阴极上观察到的现象是;石墨上红色物质析出若电解液中不加入Cu(NO3)2这样做的主要缺点是Pb将在阴极析出,Pb2+不能得到有效应用.
14.下列热化学方程式书写正确的( )
0 173289 173297 173303 173307 173313 173315 173319 173325 173327 173333 173339 173343 173345 173349 173355 173357 173363 173367 173369 173373 173375 173379 173381 173383 173384 173385 173387 173388 173389 173391 173393 173397 173399 173403 173405 173409 173415 173417 173423 173427 173429 173433 173439 173445 173447 173453 173457 173459 173465 173469 173475 173483 203614
| A. | 甲烷的燃烧热为-890 kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890 kJ/mol | |
| B. | 在一定条件下将1 molSO2和0.5molO2置于密闭容器中充分反应,放出热量79.2kJ,则反应的热化学方程式为:2SO2(g)+O2(g)═2SO3(g)△H=-158.4kJ•mol-1 | |
| C. | NaOH(s)+$\frac{1}{2}$H2SO4(浓)═Na2SO4(aq)+H2O(l)△H=-57.3kJ•mol-1 | |
| D. | 2.00gC2H2气体完全燃烧生成液态水和二氧化碳气体放出99.6kJ的热量,该反应的热化学方程式为:2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2589.6kJ•mol-1 |