4.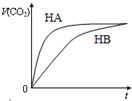 有等体积,浓度均为0.1mol/L的三种溶液:①HA溶液②HB溶液③NaHCO3溶液,已知将①、②分别与③混合,实验测得产生的CO2气体体积(v)随时间(t)变化的如图所示,下列说法正确的是( )
有等体积,浓度均为0.1mol/L的三种溶液:①HA溶液②HB溶液③NaHCO3溶液,已知将①、②分别与③混合,实验测得产生的CO2气体体积(v)随时间(t)变化的如图所示,下列说法正确的是( )
 有等体积,浓度均为0.1mol/L的三种溶液:①HA溶液②HB溶液③NaHCO3溶液,已知将①、②分别与③混合,实验测得产生的CO2气体体积(v)随时间(t)变化的如图所示,下列说法正确的是( )
有等体积,浓度均为0.1mol/L的三种溶液:①HA溶液②HB溶液③NaHCO3溶液,已知将①、②分别与③混合,实验测得产生的CO2气体体积(v)随时间(t)变化的如图所示,下列说法正确的是( )| A. | 物质酸性的比较:HB>HA>H2CO3 | |
| B. | 反应结束后所得两溶液中,c(B-)>c(A-) | |
| C. | 上述三种溶液中由水电离的c(OH-)大小:NaHCO3溶液>HB溶液>HA溶液 | |
| D. | HA溶液和NaHCO3溶液反应所得溶液中:c(A-)+c(HA)=0.10mol/L |
3.设NA表示阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 1L0.1mol/LCH3COOH溶液中含有0.1NA个氢离子 | |
| B. | 25℃是PH=13的Ba(OH)2溶液中含有0.1NA个OH- | |
| C. | 8.4gNaHCO3固体中含有0.1NA 个CO32- | |
| D. | 25℃,PH=11的Na2CO3溶液1L中由水电离出的H+的数目为10-3NA |
2.一定温度下,对于两个可逆反应A(g)+2B(g )?2C(g)和A(s)+2B(g)?2C(g),都能说明两个反应都已达到平衡的是( )
| A. | 容器内总压强不再变化 | B. | 混合气体的密度不再变化 | ||
| C. | 混合气体的平均摩尔质量不再变化 | D. | 混合气体的总质量不再变化 |
18.相同温度下,体积均为1L的两个恒容密闭容器中发生可逆反应:A(g)+2B(g)?2C(g)△H=a kJ•mol-1.(a>0),实验测得起始、平衡时的有关数据如下表所示,下列叙述错误的是( )
| 容器 编号 | 起始时各物质的物质的量/mol | 达到平衡时 体系能量的变化 | ||
| A | B | C | ||
| ① | 1 | 2 | 0 | 吸收热量:0.25akJ |
| ② | 0.5 | 1 | 1 | 吸收热量:Q kJ |
| A. | 容器①、②中反应的平衡常数相等 | |
| B. | 平衡时,两个容器中C的体积分数均约为18% | |
| C. | 容器②中达到平衡时吸收的热量Q=0.25a kJ | |
| D. | 若其他条件不变,把容器①的体积改为2L,则平衡时吸收的热量小于0.25a kJ |
17.在密闭容器中,mA(g)+bB(g)?pC(g)反应平衡时,测得 c(A)为 0.5mol•L?1,温度不变的情况下,将容器体积增大一倍,当达到新的平衡时,测得 c(A)为 0.3mol•L?1,则下列判断中正确的是( )
| A. | 平衡向正反应方向移动 | B. | 物质C的体积分数增加 | ||
| C. | 化学计量数:m+b<p | D. | 物质B的转化率减小 |
16.已知3mol碳在2mol氧气中燃烧,至反应物耗尽,测得放出热量a kJ.又知0.1mol碳完全燃烧,放出热量为 b kJ.则热化学方程式C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=Q中Q等于( )
0 173221 173229 173235 173239 173245 173247 173251 173257 173259 173265 173271 173275 173277 173281 173287 173289 173295 173299 173301 173305 173307 173311 173313 173315 173316 173317 173319 173320 173321 173323 173325 173329 173331 173335 173337 173341 173347 173349 173355 173359 173361 173365 173371 173377 173379 173385 173389 173391 173397 173401 173407 173415 203614
| A. | -(a-b) kJ•mol-1 | B. | -(a+b) kJ•mol-1 | ||
| C. | -(5a-0.5b) kJ•mol-1 | D. | -(0.5a-5b) kJ•mol-1 |