4.SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.
(1)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是2OH-+SO2=H2O+SO32-.
(2)吸收液吸收SO2的过程中,pH随n(SO32-),n(HSO3-)变化关系如下表:
1表判断NaHSO3溶液显酸性,用化学平衡原理解释:HSO3-?H++SO32-,显酸性是因其电离大于其水解
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):ab
a.c(Na-)=2c(SO${\;}_{3}^{-}$)+c(HSO${\;}_{3}^{2-}$)
b.c(Na-)>c(HSO${\;}_{3}^{-}$)>c(SO${\;}_{3}^{2-}$)>c(H-)=c(OH-)
c.c(Na+)+c(H+)=c(SO${\;}_{3}^{2-}$)+c(HSO${\;}_{3}^{-}$)+c(OH-)
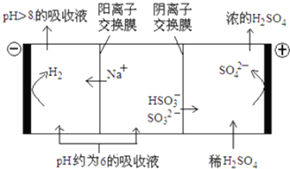
(3)当吸收液的pH降至约为6时,送至电解槽再生.再生示意图如下:
①HSO3-在阳极放电的电极反应式是HSO3--2e-+H2O=SO42-+3H+.
②当阴极室中溶液PH升至8以上时,吸收液再生并循环利用.简述再生原理:H+在阴极得电子生成H2,溶液中的c(H+)降低,促使HSO3-电离生成SO32-,且Na+进入阴极室,吸收液得以再生.

(1)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是2OH-+SO2=H2O+SO32-.
(2)吸收液吸收SO2的过程中,pH随n(SO32-),n(HSO3-)变化关系如下表:
| n(SO32-):,n(HSO3-) | 91:9 | 1:1 | 1:91 |
| PH | 8.2 | 7.2 | 6.2 |
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):ab
a.c(Na-)=2c(SO${\;}_{3}^{-}$)+c(HSO${\;}_{3}^{2-}$)
b.c(Na-)>c(HSO${\;}_{3}^{-}$)>c(SO${\;}_{3}^{2-}$)>c(H-)=c(OH-)
c.c(Na+)+c(H+)=c(SO${\;}_{3}^{2-}$)+c(HSO${\;}_{3}^{-}$)+c(OH-)
(3)当吸收液的pH降至约为6时,送至电解槽再生.再生示意图如下:
①HSO3-在阳极放电的电极反应式是HSO3--2e-+H2O=SO42-+3H+.
②当阴极室中溶液PH升至8以上时,吸收液再生并循环利用.简述再生原理:H+在阴极得电子生成H2,溶液中的c(H+)降低,促使HSO3-电离生成SO32-,且Na+进入阴极室,吸收液得以再生.
3.镍是重要的有色金属之一,但粗镍中一般含有Fe、Cu及难与酸、碱溶液反应的不溶性杂质而影响使用.现对粗镍进行提纯,具体的反应流程如下:
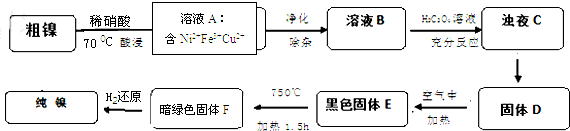
已知:
①2Ni2O3(黑色)$\frac{\underline{\;750℃\;}}{\;}$4NiO(黑色)+O2↑
②
根据信息回答:
(1)28Ni在周期表中的第四周期;镍与稀硝酸反应的离子方程式为3Ni+8H++2NO3-=3Ni2++2NO↑+4H2O.实验表明镍的浸出率与温度有关,随着温度升高镍的浸出率增大,但当温度高于70℃时,镍的浸出率又降低,浸出渣中Ni(OH)2含量增大,其原因为温度升高时,Ni2+的水解程度变大;
(2)在溶液A的净化除杂中,先调节PH=5.5,加热煮沸5min,静置一段时间后,过滤出Fe(OH)3.为了得到纯净的溶液B还需要加入以下物质C进行除杂(填正确答案标号).
A、NaOH B、Na2S C、H2S D、NH3﹒H2O
(3)已知以下三种物质的溶解度关系:NiC2O4>NiC2O4•H2O>NiC2O4•2H2O.由浊液C得到固体D的操作包括过滤、洗涤、干燥(填操作名称); D生成E的化学方程式为4NiC2O4•2H2O+3 O2=2Ni2O3+8CO2↑+8H2O.
(4)1molE经上述流程得到纯镍,理论上参加反应的氢气为2 mol.
(5)测定样品中的镍含量的基本思路是将Ni2+转化为沉淀,通过测量沉淀的质量进一步推算Ni含量.已知Ni2+能与CO32-,C2O42-、S2-等离子形成沉淀,但测定时常选用丁二酮肟(C4H8N2O2)作沉淀剂,生成分子式为C8H14N4O4Ni的鲜红色沉淀.从实验误差角度分析主要原因为:生成沉淀质量大,称量误差小,分析结果准确度高.

已知:
①2Ni2O3(黑色)$\frac{\underline{\;750℃\;}}{\;}$4NiO(黑色)+O2↑
②
| 物质 | CuS | Cu(OH)2 | Ni(OH)2 | NiS |
| Ksp | 8.8×10-38 | 2.2×10-20 | 5.48×10-18 | 3.2×1018 |
(1)28Ni在周期表中的第四周期;镍与稀硝酸反应的离子方程式为3Ni+8H++2NO3-=3Ni2++2NO↑+4H2O.实验表明镍的浸出率与温度有关,随着温度升高镍的浸出率增大,但当温度高于70℃时,镍的浸出率又降低,浸出渣中Ni(OH)2含量增大,其原因为温度升高时,Ni2+的水解程度变大;
(2)在溶液A的净化除杂中,先调节PH=5.5,加热煮沸5min,静置一段时间后,过滤出Fe(OH)3.为了得到纯净的溶液B还需要加入以下物质C进行除杂(填正确答案标号).
A、NaOH B、Na2S C、H2S D、NH3﹒H2O
(3)已知以下三种物质的溶解度关系:NiC2O4>NiC2O4•H2O>NiC2O4•2H2O.由浊液C得到固体D的操作包括过滤、洗涤、干燥(填操作名称); D生成E的化学方程式为4NiC2O4•2H2O+3 O2=2Ni2O3+8CO2↑+8H2O.
(4)1molE经上述流程得到纯镍,理论上参加反应的氢气为2 mol.
(5)测定样品中的镍含量的基本思路是将Ni2+转化为沉淀,通过测量沉淀的质量进一步推算Ni含量.已知Ni2+能与CO32-,C2O42-、S2-等离子形成沉淀,但测定时常选用丁二酮肟(C4H8N2O2)作沉淀剂,生成分子式为C8H14N4O4Ni的鲜红色沉淀.从实验误差角度分析主要原因为:生成沉淀质量大,称量误差小,分析结果准确度高.
2.“8.12”天津港爆炸中有一定量的氰化物泄露.氰化物多数易溶于水,有剧毒,易造成水污染.为了增加对氰化物的了解,同学们查找资料进行学习和探究.
探究一:探究氰化物的性质
已知部分弱酸的电离平衡常数如下表:
(1)NaCN溶液呈碱性的原因是CN-+H2O?HCN+OH- (用离子方程式表示)
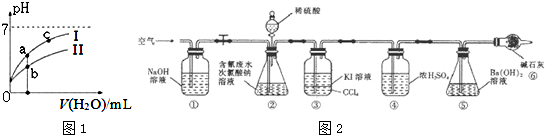
(2)如图1表示常温下,稀释HCOOH、HCN两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是CD
A.相同浓度的HCOONa和NaCN的混合溶液中,各离子浓度
的大小关系是:c(Na+)>c(CN-)>c(HCOO-)>c(OH-)>c(H+)
B.向NaCN溶液中通入少量二氧化碳的离子方程式为:
CN-+CO2+H2O=HCN+CO32-
C.图象中a、c两点处的溶液中$\frac{c({R}^{-})}{c(HR).c(O{H}^{-})}$相等(HR代表HCOOH或HCN)
D.图象中a点酸的总浓度小于b点酸的总浓度
(3)H2O2有“绿色氧化剂”的美称;也可消除水中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O═A+NH3↑,则生成物A的化学式为KHCO3.
(4)处理含CN-废水时,如用NaOH溶液调节pH至9时,此时c(CN-)<c(HCN)(填“>”、“<”或“=”)
探究二:测定含氰水样中处理百分率
为了测定含氰水样中处理百分率,同学们利用如图2所示装置进行实验.将CN-的浓度为0.2000mol/L的含氰废水100mL与100mL NaClO溶液(过量)置于装置②锥形瓶中充分反应.打开分液漏斗活塞,滴人100mL稀H2SO4,关闭活塞.
已知装置②中发生的主要反应依次为:
CN-+ClO-═CNO-+Cl-
2CNO-+2H++3C1O-═N2↑+2CO2↑+3C1-+H2O
(5)①和⑥的作用是吸收空气中二氧化碳排除空气中二氧化碳对实验的干扰.
(6)反应结束后,缓缓通人空气的目的是使生成的气体全部进入装置⑤.
(7)为了计算该实验装置②锥形瓶中含氰废水被处理的百分率,实验中需要测定装置⑤反应前后的质量(从装置①到⑥中选择,填装置序号).

探究一:探究氰化物的性质
已知部分弱酸的电离平衡常数如下表:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 ( 25℃) | Ki=1.77×10-4 | Ki=5.0×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
(2)如图1表示常温下,稀释HCOOH、HCN两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是CD
A.相同浓度的HCOONa和NaCN的混合溶液中,各离子浓度
的大小关系是:c(Na+)>c(CN-)>c(HCOO-)>c(OH-)>c(H+)
B.向NaCN溶液中通入少量二氧化碳的离子方程式为:
CN-+CO2+H2O=HCN+CO32-
C.图象中a、c两点处的溶液中$\frac{c({R}^{-})}{c(HR).c(O{H}^{-})}$相等(HR代表HCOOH或HCN)
D.图象中a点酸的总浓度小于b点酸的总浓度
(3)H2O2有“绿色氧化剂”的美称;也可消除水中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O═A+NH3↑,则生成物A的化学式为KHCO3.
(4)处理含CN-废水时,如用NaOH溶液调节pH至9时,此时c(CN-)<c(HCN)(填“>”、“<”或“=”)
探究二:测定含氰水样中处理百分率
为了测定含氰水样中处理百分率,同学们利用如图2所示装置进行实验.将CN-的浓度为0.2000mol/L的含氰废水100mL与100mL NaClO溶液(过量)置于装置②锥形瓶中充分反应.打开分液漏斗活塞,滴人100mL稀H2SO4,关闭活塞.
已知装置②中发生的主要反应依次为:
CN-+ClO-═CNO-+Cl-
2CNO-+2H++3C1O-═N2↑+2CO2↑+3C1-+H2O
(5)①和⑥的作用是吸收空气中二氧化碳排除空气中二氧化碳对实验的干扰.
(6)反应结束后,缓缓通人空气的目的是使生成的气体全部进入装置⑤.
(7)为了计算该实验装置②锥形瓶中含氰废水被处理的百分率,实验中需要测定装置⑤反应前后的质量(从装置①到⑥中选择,填装置序号).
1.下列各表述与示意图一致的是( )
| A. | 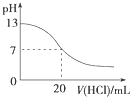 图表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 | |
| B. | 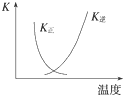 图中曲线表示反应2SO2(g)+O2(g)?2SO3(g)△H<0正、逆反应的平衡常数K随温度的变化 图中曲线表示反应2SO2(g)+O2(g)?2SO3(g)△H<0正、逆反应的平衡常数K随温度的变化 | |
| C. |  图表示10 mL 0.01 mol•L-1 KMnO4酸性溶液与过量的0.1 mol•L-1 H2C2O4溶液混合时,n(Mn2+)随时间的变化 | |
| D. | 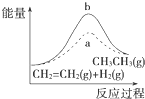 图中a、b曲线分别表示反应CH2═CH2(g)+H2(g)-→CH3CH3(g)△H<0使用和未使用催化剂时,反应过程中的能量变化 |
17.下列离子方程式中,错误的是( )
| A. | 碳酸钠溶液跟足量稀H2SO4混合:CO32-+2H+═H2O+CO2↑ | |
| B. | 硝酸铜溶液中滴加烧碱溶液:Cu2++2OH-═Cu(OH)2↓ | |
| C. | 次氯酸溶液中加入氢氧化钾溶液:H++OH-═H2O | |
| D. | 碳酸钙溶于醋酸CaCO3+2CH3COOH═Ca2++2CH3COO-+H2O+CO2↑ |
16.和下列离子反应方程式相对应的化学方程式正确的是( )
0 173203 173211 173217 173221 173227 173229 173233 173239 173241 173247 173253 173257 173259 173263 173269 173271 173277 173281 173283 173287 173289 173293 173295 173297 173298 173299 173301 173302 173303 173305 173307 173311 173313 173317 173319 173323 173329 173331 173337 173341 173343 173347 173353 173359 173361 173367 173371 173373 173379 173383 173389 173397 203614
| A. | Zn2++2OH-=Zn(OH)2↓ ZnCO3+2NaOH=Zn(OH)2↓+Na2CO3 | |
| B. | Ba2++SO42-=BaSO4↓ Ba(OH)2+H2SO4=BaSO↓+2H2O | |
| C. | Ag++Cl-=AgCl↓ AgNO3+NaCl=AgCl↓+NaNO3 | |
| D. | Cu+2Ag+=Cu2++2Ag↓ Cu+2AgCl=2Ag+CuCl2 |