题目内容
19.钠和水反应的离子方程式2Na+2H2O═2Na++2OH-+H2↑.分析 钠与水反应生成氢氧化钠和氢气,该反应中只有氢氧化钠可以拆开,其它物质需要保留化学式,据此写出反应的离子方程式.
解答 解:钠的化学性质比较活泼,能够与水反应生成氢氧化钠和氢气,该反应的离子方程式为:2Na+2H2O═2Na++2OH-+H2↑,
故答案为:2Na+2H2O═2Na++2OH-+H2↑.
点评 本题考查了离子方程式的书写,题目难度不大,明确钠与水反应的原理为解答关键,注意掌握离子方程式的书写原则,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
2.下列有机反应物和有机产物在核磁共振氢谱中吸收峰的数目相同的是( )
| A. | CH3-CH2-CH2-CHO与新制氢氧化铜悬浊液加热反应,最后酸化 | |
| B. | 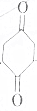 与足量氢气在催化剂、加热条件下反应 与足量氢气在催化剂、加热条件下反应 | |
| C. | 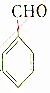 与足量氢气在催化剂、加热条件下反应 与足量氢气在催化剂、加热条件下反应 | |
| D. | 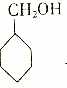 与氧气在催化剂、加热条件下反应 与氧气在催化剂、加热条件下反应 |
10.反应N2(g)+3H2(g)═2NH3(g)的平衡常数为K1,在相同的条件下NH3(g)?$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)的平衡常数为K2,则下列关系正确的是( )
| A. | K1=K2 | B. | K1=$\frac{1}{{K}_{2}}$ | C. | K1=(K2)2 | D. | K1=($\frac{1}{{K}_{2}}$)2 |
7.下列事实中,与电化学腐蚀无关的是( )
| A. | 在空气中,金属银的表面生成一层黑色物质 | |
| B. | 镀银的铁制品,镀层部分受损后,露出的铁表面易被腐蚀 | |
| C. | 埋在潮湿疏松土壤里的铁管比埋在干燥致密不透气的土壤里的铁管更易被腐蚀 | |
| D. | 为保护海轮的船壳,常在船壳上镶入锌块 |
4.SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.
(1)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是2OH-+SO2=H2O+SO32-.
(2)吸收液吸收SO2的过程中,pH随n(SO32-),n(HSO3-)变化关系如下表:
1表判断NaHSO3溶液显酸性,用化学平衡原理解释:HSO3-?H++SO32-,显酸性是因其电离大于其水解
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):ab
a.c(Na-)=2c(SO${\;}_{3}^{-}$)+c(HSO${\;}_{3}^{2-}$)
b.c(Na-)>c(HSO${\;}_{3}^{-}$)>c(SO${\;}_{3}^{2-}$)>c(H-)=c(OH-)
c.c(Na+)+c(H+)=c(SO${\;}_{3}^{2-}$)+c(HSO${\;}_{3}^{-}$)+c(OH-)
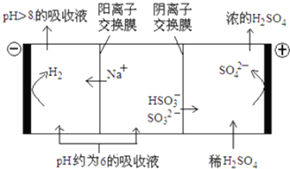
(3)当吸收液的pH降至约为6时,送至电解槽再生.再生示意图如下:
①HSO3-在阳极放电的电极反应式是HSO3--2e-+H2O=SO42-+3H+.
②当阴极室中溶液PH升至8以上时,吸收液再生并循环利用.简述再生原理:H+在阴极得电子生成H2,溶液中的c(H+)降低,促使HSO3-电离生成SO32-,且Na+进入阴极室,吸收液得以再生.

(1)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是2OH-+SO2=H2O+SO32-.
(2)吸收液吸收SO2的过程中,pH随n(SO32-),n(HSO3-)变化关系如下表:
| n(SO32-):,n(HSO3-) | 91:9 | 1:1 | 1:91 |
| PH | 8.2 | 7.2 | 6.2 |
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):ab
a.c(Na-)=2c(SO${\;}_{3}^{-}$)+c(HSO${\;}_{3}^{2-}$)
b.c(Na-)>c(HSO${\;}_{3}^{-}$)>c(SO${\;}_{3}^{2-}$)>c(H-)=c(OH-)
c.c(Na+)+c(H+)=c(SO${\;}_{3}^{2-}$)+c(HSO${\;}_{3}^{-}$)+c(OH-)
(3)当吸收液的pH降至约为6时,送至电解槽再生.再生示意图如下:
①HSO3-在阳极放电的电极反应式是HSO3--2e-+H2O=SO42-+3H+.
②当阴极室中溶液PH升至8以上时,吸收液再生并循环利用.简述再生原理:H+在阴极得电子生成H2,溶液中的c(H+)降低,促使HSO3-电离生成SO32-,且Na+进入阴极室,吸收液得以再生.
11.在C(s)+CO2(g)?2CO(g)反应中,可使反应速率增大的措施是( )
①增大压强
②增加碳的量
③恒容通入CO2
④恒容下充入N2
⑤恒容通入CO.
①增大压强
②增加碳的量
③恒容通入CO2
④恒容下充入N2
⑤恒容通入CO.
| A. | ①③④ | B. | ③④⑤ | C. | ①③⑤ | D. | ②③⑤ |
9.下列说法正确的是( )
| A. | 18 g H2O在标准状况下的体积是22.4 L | |
| B. | 22.4 L O2中一定含有6.02×1023个氧分子 | |
| C. | 在标准状况时,20 mL NH3与60 mL N2所含的原子个数比为2:3 | |
| D. | 将80 g NaOH溶于1 L水中,所得溶液中NaOH的物质的量浓度为2 moL/L |
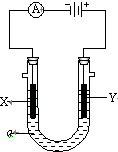 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a;
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a;