16.向2.0L恒容密闭容器中充入1.0mol PCl5,在温度为T时发生如下反应PCl5(g)?PCl3(g)+Cl2(g)△H=+124kJ•mol-1.反应过程中测定的部分数据见下表:
回答下列问题:
(1)反应在前50s的平均速率v(PCl5)=0.0016mol/(L•s).
(2)温度为T时,该反应的化学平衡常数=0.025.
(3)上述反应到达平衡状态时,PCl3的体积分数为16.7%.
要提高平衡时PCl3的体积分数,可采取的措施有CD.
A.温度不变,压缩容器体积增大压强 B.使用高效催化剂
C.温度和体积不变,减小PCl5的起始量 D.体积不变,提高反应温度
(4)在温度为T时,若起始时向容器中充入0.5mol PCl5和a mol Cl2平衡时PCl5的转化率仍为20%,则a=0.1.
(5)在热水中,五氯化磷完全水解,生成磷酸(H3PO4),该反应的化学方程式是PCl5+4H2O=H3PO4+5HCl.
| 时间t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 |
(1)反应在前50s的平均速率v(PCl5)=0.0016mol/(L•s).
(2)温度为T时,该反应的化学平衡常数=0.025.
(3)上述反应到达平衡状态时,PCl3的体积分数为16.7%.
要提高平衡时PCl3的体积分数,可采取的措施有CD.
A.温度不变,压缩容器体积增大压强 B.使用高效催化剂
C.温度和体积不变,减小PCl5的起始量 D.体积不变,提高反应温度
(4)在温度为T时,若起始时向容器中充入0.5mol PCl5和a mol Cl2平衡时PCl5的转化率仍为20%,则a=0.1.
(5)在热水中,五氯化磷完全水解,生成磷酸(H3PO4),该反应的化学方程式是PCl5+4H2O=H3PO4+5HCl.
15.下列说法正确的是( )
| A. | 强酸跟强碱的反应热一定是中和热 | |
| B. | 1molC完全燃烧放热383.3kJ,其热化学方程为:C+O2═CO2 △H=-383.3kJ•mol-1 | |
| C. | 在稀溶液中,酸与碱发生中和反应生成1mol H2O时的反应热叫做中和热 | |
| D. | 表示中和热的离子方程式为:H+(aq)+OH-(aq)═H2O(l);△H=57.3KJ•mol-1 |
13.向某密闭容器中加入0.3mol A、0.1mol C和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如甲图所示[t0~t1阶段的c(B)变化未画出].乙图为t2时刻后改变条件平衡体系中正、逆反应速率随时间变化的情况,且四个阶段都各改变一种反应条件且互不相同,t3~t4阶段为使用催化剂.下列说法中正确的是( )


| A. | 若t1=15 s,则用A的浓度变化表示的t0~t1段的平均反应速率为0.004mol•L-1•s-1 | |
| B. | t4~t5阶段改变的条件一定为增大压强 | |
| C. | 该容器的容积为2 L,B的起始物质的量为0.02 mol | |
| D. | t5~t6阶段,容器内A的物质的量减少了0.06 mol,而此过程中容器与外界的热交换总量为a kJ,该反应的热化学方程式为:3A(g)?B(g)+2C(g)△H=+50a kJ•mol-1 |
11. “低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.所以“低碳经济”正成为科学家研究的主要课题.
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.所以“低碳经济”正成为科学家研究的主要课题.
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式,并在方框内填上系数.
□C+□KMnO4+□H2SO4=□CO2↑+□MnSO4+□K2SO4+□6H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下二组数据:
①实验1条件下,反应从开始至达到平衡,以v(CO2) 表示的反应速率为0.13mol/(L•min)
(保留小数点后二位数,下同).
②实验2条件下平衡常数K=0.17,该反应为放热(填“吸热”或“放热”)反应.
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H1=-1275.6kJ/mol
②2CO (g)+O2(g)═2CO2(g)△H2=-566.0kJ/mol
③H2O(g)═H2O(l)△H3=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(g)△H=-354.8KJ/mol.
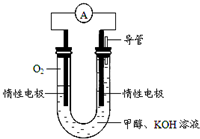
(4)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置.
①该电池正极的电极反应式为:O2+4e-+2H2O=4OH-;该电极上每消耗1.6g氧气,转移的电子数为0.2mol.
②该电池工作时,溶液中的OH-向负(填“正”或“负”)极移动.
 “低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.所以“低碳经济”正成为科学家研究的主要课题.
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.所以“低碳经济”正成为科学家研究的主要课题.(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式,并在方框内填上系数.
□C+□KMnO4+□H2SO4=□CO2↑+□MnSO4+□K2SO4+□6H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下二组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
(保留小数点后二位数,下同).
②实验2条件下平衡常数K=0.17,该反应为放热(填“吸热”或“放热”)反应.
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H1=-1275.6kJ/mol
②2CO (g)+O2(g)═2CO2(g)△H2=-566.0kJ/mol
③H2O(g)═H2O(l)△H3=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(g)△H=-354.8KJ/mol.
(4)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置.
①该电池正极的电极反应式为:O2+4e-+2H2O=4OH-;该电极上每消耗1.6g氧气,转移的电子数为0.2mol.
②该电池工作时,溶液中的OH-向负(填“正”或“负”)极移动.
9.已知在25℃下,101kPa下,1g辛烷C8H18燃烧生成二氧化碳和液态水时放出48.40kJ热量.表示上述反应的热化学方程式正确的是( )
0 173137 173145 173151 173155 173161 173163 173167 173173 173175 173181 173187 173191 173193 173197 173203 173205 173211 173215 173217 173221 173223 173227 173229 173231 173232 173233 173235 173236 173237 173239 173241 173245 173247 173251 173253 173257 173263 173265 173271 173275 173277 173281 173287 173293 173295 173301 173305 173307 173313 173317 173323 173331 203614
| A. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(g)△H=-48.40kJ•mol-1 | |
| B. | 2C8H18(l)+25O2(g)═16CO2(g)+18H2O(g)△H=+11035.2kJ•mol-1 | |
| C. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(l)△H=+5517.6kJ•mol-1 | |
| D. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(l)△H=-5517.6kJ•mol-1 |
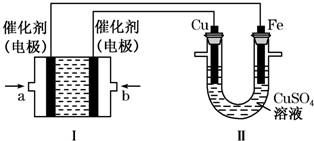
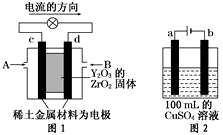 (1)“天宫一号”于2011年9月在酒泉卫星发射中心发射,标志着我国的航空航天技术迈进了一大步.火箭的第一、二级发动机中,所用的燃料为偏二甲胼和四氧化二氮,偏二甲肼可用胼来制备.
(1)“天宫一号”于2011年9月在酒泉卫星发射中心发射,标志着我国的航空航天技术迈进了一大步.火箭的第一、二级发动机中,所用的燃料为偏二甲胼和四氧化二氮,偏二甲肼可用胼来制备.