题目内容
17.甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:(1)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=+260kJ•mol-1
已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1
则CH4与O2反应生成CO和H2的热化学方程式为2CH4(g)+O2(g)═2CO(g)+4H2(g)△H=-46kJ•mol-1;
(2)如图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜.
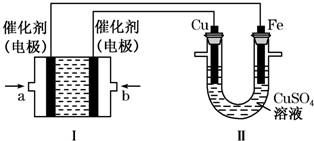
①a处应通入CH4(填“CH4”或“O2”),b处电极上发生的电极反应式是O2+2H2O+4e=4OH-;②电镀结束后,装置Ⅰ中溶液的pH变小(填写“变大”“变小”或“不变”,下同),
装置Ⅱ中Cu2+的物质的量浓度不变;
③电镀结束后,装置Ⅰ溶液中的阴离子除了OH-以外还含有CO32-、HCO3-;
④若将装置I中电解质溶液换成硫酸溶液,则在工作过程中H+ 移向b电极(填“a”或“b”),a处电极上发生的电极反应式为CH4+8e-+2H2O═CO2+8H+.
分析 (1)已知CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=+260kJ•mol-1①,
2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1②,
将方程式2×①+②可得CH4与O2反应生成CO和H2的热化学方程式;
(2)①II中首先镀铜,则Cu作阳极、Fe作阴极,I中a处电极为负极、b处电极为正极,负极上通入燃料、正极上通入氧化剂;甲烷失电子和氢氧根离子反应生成碳酸根离子和水;
②根据I中氢氧根离子浓度变化确定溶液pH变化;II中发生电镀,阳极上溶解的铜质量等于阴极上析出铜的质量;
③I中还有碳酸根离子和碳酸氢根离子生成;
④II中首先镀铜,则Cu作阳极、Fe作阴极,I中a处电极为负极、b处电极为正极,原电池中电解质溶液中阳离子移向正极,a处电极上发生的电极反应是甲烷失电子发生氧化反应生成二氧化碳,结合电荷守恒书写电极反应;
解答 解:(1)CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=+260kJ•mol-1①,
2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1②,
将方程式2×①+②得 2CH4(g)+O2(g)═2CO(g)+4H2(g)△H=-46kJ•mol-1 ,
故答案为:2CH4(g)+O2(g)═2CO(g)+4H2(g)△H=-46kJ•mol-1 ;
(2)①II中首先镀铜,则Cu作阳极、Fe作阴极,I中a处电极为负极、b处电极为正极,负极上通入燃料、正极上通入氧化剂,所以a处通入的气体是甲烷;甲烷失电子和氢氧根离子反应生成碳酸根离子和水,电极反应为CH4+10OH--8e-=CO32-+7H2O,b处通的是氧气,电极上发生的电极反应式是:O2+2H2O+4e=4OH-;
故答案为:CH4;O2+2H2O+4e=4OH-;
②根据I中电池反应为CH4+2O2+2KOH=K2CO3+3H2O,KOH参加反应导致溶液中KOH浓度降低,则溶液的pH减小;
II中发生电镀,阳极上溶解的铜质量等于阴极上析出铜的质量,则溶液中铜离子浓度不变,
故答案为:变小;不变;
③I中负极反应为CH4+10OH--8e-=CO32-+7H2O,所以还有碳酸根离子、碳酸氢根离子生成,离子为:CO32-、HCO3-,
故答案为:CO32-、HCO3-;
④II中首先镀铜,则Cu作阳极、Fe作阴极,I中a处电极为负极、b处电极为正极,原电池中电解质溶液中阳离子移向正极,a处电极上发生的电极反应是甲烷失电子发生氧化反应生成二氧化碳,结合电荷守恒书写电极反应为:CH4+8e-+2H2O═CO2+8H+,
故答案为:b,CH4+8e-+2H2O═CO2+8H+;
点评 本题考查了盖斯定律、原电池和电解池原理,平衡标志和判断,图象分析方法,根据电解池中Cu、Fe电极上发生的反应确定燃料电池中正负极及电极上通入的气体,再结合转移电子相等计算,难点是电极反应式的书写,题目难度中等.

| A. | 放入0.2mol SO2、0.1molO2、0.1mol SO3,达到平衡时SO3必小于amol | |
| B. | 放入0.2mol SO2、0.1molO2、0.2mol SO3,达到平衡时SO3必大于amol | |
| C. | 放入0.4mol SO2、0.1molO2,达到平衡时SO3会等于0.4amol | |
| D. | 放入0.2mol SO2、0.1molO2,达到平衡时SO3必小于amol |
| 0.01mol/L KIO3溶液的体积/mL | Na2SO3溶液的体积/mL | H2O的 体积/mL | 实验温度/℃ | 溶液出现蓝色所需的时间 | |
| 实验1 | 5 | 5 | V1 | 0 | a |
| 实验2 | 5 | 5 | 40 | 25 | b |
| 实验3 | 5 | V2 | 35 | 25 | c |
(2)V1=40 mL,V2=10 mL.
(3)如果研究Na2SO3溶液浓度对反应速率的影响,使用实验2和实验3.
(4)对比实验1和实验2,可以研究温度对化学反应速率的影响.
(5)溶液出现蓝色所需的时间从大到小的顺序是a>b>c(用a、b、c表示).
| A. | 2H2(g)+O2(g)═2H2O(l)△H=-285.8KJ•mol-1 | |
| B. | 2H2(g)+O2(g)═2H2O(l)△H=+285.8KJ•mol-1 | |
| C. | H2(g)+O2(g)═H2O(l)△H=-285.8KJ•mol-1 | |
| D. | H2(g)+O2(g)═H2O(g)△H=-285.8KJ•mol-1 |
| A. | HNO3(aq)+KOH(aq)═H2O(l)+KNO3(aq)△H>-57.3kJ/mol. | |
| B. | HNO3(aq)+NH3•H2O(aq)═H2O(l)+KNO3(aq)△H<-57.3kJ/mol. | |
| C. | CH3COOH(aq)+KOH(aq)═H2O(l)+CH3COOK(aq)△H<-57.3kJ/mol. | |
| D. | CH3COOH(aq)+NaOH(aq)═H2O(l)+CH3COONa(aq)△H>-57.3kJ/mol. |
| A. | N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=534.4kJ•mol-1 | |
| B. | N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.4kJ•mol-1 | |
| C. | N2H4(g)+O2(g)═N2(g)+2H2O(l)△H=-534.4kJ•mol-1 | |
| D. | N2H4(g)+O2(g)═N2+2H2O△H=-534.4kJ•mol-1 |
| A. | pH=1的溶液中:Fe2+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$、Na+ | |
| B. | 某无色溶液中:NH${\;}_{4}^{+}$、Al3+、HCO${\;}_{3}^{-}$、Cl- | |
| C. | 澄清透明溶液中:K+、Fe3+、SO${\;}_{4}^{2-}$、NO${\;}_{3}^{-}$ | |
| D. | 由水电离的c (H+)=1×10-14 mol•L-1的溶液中:Ca2+、K+、Cl-、HCO${\;}_{3}^{-}$ |
 已知热化学方程式H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,
已知热化学方程式H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,