14.在标准状况下,将aLNH3完全溶于水得到V mL氨水,溶液的密度为ρg/cm3,溶质的质量分数为ω,溶质的物质的量浓度为cmol/L.下列叙述中正确的是( )
| A. | ω=$\frac{35a}{22.4Vρ}$×100% | |
| B. | c=$\frac{1000a}{22.4Vρ}$×100%mol/L | |
| C. | 上述溶液中再加入1.5VmL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:c(NH4+)>c(Cl-)>c(H+)>c(OH-) | |
| D. | 上述氨水中再加入V mL水后,所得溶液的质量分数大于0.5ω |
13.如表所示为部分短周期元素的原子半径及主要化合价,根据表中信息判断下列叙述正确的是( )
| 元素代号 | A | B | C | D | E | F | G |
| 原子半径/nm | 0.182 | 0.160 | 0.089 | 0.143 | 0.102 | 0.099 | 0.071 |
| 主要化合价 | +1 | +2 | +2 | +3 | +6、-2 | -1 | -1 |
| A. | D、B简单离子半径大小关系为D3+>B2+ | |
| B. | B2+、D3+、E2-、G-四种离子的核外电子排布相同 | |
| C. | 最高价氧化物对应的水化物的酸性:H2EO4>HFO4 | |
| D. | 气态氢化物的稳定性HG>HF>H2E |
12.合成氨反应为N2+3H2≒2NH3,今有A、B、C、D四个容器,每个容器中有两种操作,两种操作分别达到平衡后,操作1中N2和操作2中NH3转化率之和一定不为1的是(起始体积相等)( )
| A. | 恒温恒容:操作1:加1mol N2+3mol H2,操作2:加2mol NH3 | |
| B. | 恒温恒压:操作1:加1mol N2+3mol H2,操作2:加2mol NH3 | |
| C. | 恒温恒容:操作1:加1mol N2+3mol H2,操作2:加3mol NH3 | |
| D. | 恒温恒压:操作1:加1mol N2+3mol H2,操作2:加3mol NH3 |
11.由短周期元素构成的某离子化合物的固体中,一个阳离子和一个阴离子核外电子数之和为20.下列说法中不正确的是( )
| A. | 固体中阳离子和阴离子个数不一定相等 | |
| B. | 固体中一定有离子键可能有共价键 | |
| C. | 若X只含两种元素,所含元素一定不在同一周期也不在同一主族 | |
| D. | 固体中阳离子半径一定大于阴离子半径 |
10.设NA表示阿伏加德罗常数值,下列说法正确的是( )
| A. | 1 L 1mol/L CH3COONa溶液中存在NA个CH3COO-离子 | |
| B. | 在标准状况下,22.4LSO3含有3NA个氧原子 | |
| C. | 1 mol Cl2参加化学反应获得的电子数都是2NA | |
| D. | 1 mol NO2气体降温后颜色变浅,其所含的原子数仍为3NA |
9.在盛有稀硫酸的烧杯中放入用导线连接的锌片和铜片,下列叙述正确的是( )
0 173129 173137 173143 173147 173153 173155 173159 173165 173167 173173 173179 173183 173185 173189 173195 173197 173203 173207 173209 173213 173215 173219 173221 173223 173224 173225 173227 173228 173229 173231 173233 173237 173239 173243 173245 173249 173255 173257 173263 173267 173269 173273 173279 173285 173287 173293 173297 173299 173305 173309 173315 173323 203614
| A. | 铜片上发生了还原反应 | |
| B. | 电子通过导线由铜片流向锌片 | |
| C. | 正极有O2逸出 | |
| D. | 正极附近的SO42-离子浓度逐渐增大 |
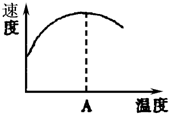 酶是蛋白质,具有蛋白质的特性,酶能催化很多化学反应,如图表示酶参加的反应中,温度与反应速率的关系,解释曲线变化原因升高温度,增大反应速率,温度过高,使催化剂失去活性,反应速率减小.
酶是蛋白质,具有蛋白质的特性,酶能催化很多化学反应,如图表示酶参加的反应中,温度与反应速率的关系,解释曲线变化原因升高温度,增大反应速率,温度过高,使催化剂失去活性,反应速率减小.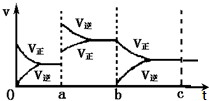 如图表示在密闭容器中反应:2SO2+O2?2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是升温;bc过程与ab过程相比化学平衡常数不变.(填“增大”“减小”或“不变”)
如图表示在密闭容器中反应:2SO2+O2?2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是升温;bc过程与ab过程相比化学平衡常数不变.(填“增大”“减小”或“不变”)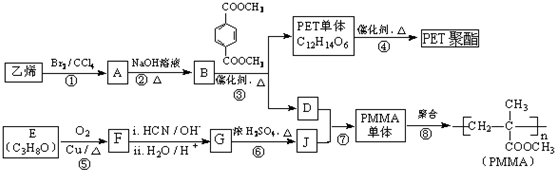
 (R、R’代表烃基)
(R、R’代表烃基) .
.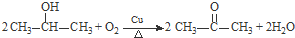 .
.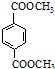 与足量NaOH溶液反应时,最多消耗4mol NaOH
与足量NaOH溶液反应时,最多消耗4mol NaOH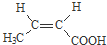 .
. .
.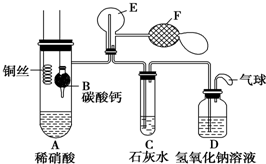 Ⅰ.乙组同学用如图装置来证明铜与稀硝酸反应产生一氧化氮,B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.
Ⅰ.乙组同学用如图装置来证明铜与稀硝酸反应产生一氧化氮,B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.