题目内容
8.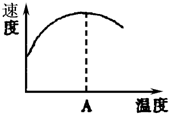 酶是蛋白质,具有蛋白质的特性,酶能催化很多化学反应,如图表示酶参加的反应中,温度与反应速率的关系,解释曲线变化原因升高温度,增大反应速率,温度过高,使催化剂失去活性,反应速率减小.
酶是蛋白质,具有蛋白质的特性,酶能催化很多化学反应,如图表示酶参加的反应中,温度与反应速率的关系,解释曲线变化原因升高温度,增大反应速率,温度过高,使催化剂失去活性,反应速率减小.
分析 酶作催化剂时,有一个最适宜温度,低于此温度,酶的催化效果不明显,高于此温度,酶易变性,以此解答该题.
解答 解:升高温度,可增大反应速率,催化剂加快反应速率,但高温下酶发生变性,失去催化作用,反应速率减慢,
故答案为:升高温度,增大反应速率,温度过高,使催化剂失去活性,反应速率减小.
点评 本题考查影响反应速率的因素,为高频考点,把握催化剂对反应速率的影响及蛋白质的性质为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.关于如图所示的①、②两个装置的叙述,正确的是( )


| A. | 装置名称:①是原电池,②是电解池 | |
| B. | 电极反应式:①中阳极:4OH--4e-═2H2O+O2↑ ②中正极:2H++2e-═H2↑ | |
| C. | 硫酸浓度变化:①减小,②增大 | |
| D. | 离子移动方向:①中H+向阴极方向移动,②中H+向负极方向移动 |
19.下列各组混合物中,能用分液漏斗进行分离的是( )
| A. | 水和CCl4 | B. | 碘和酒精 | ||
| C. | 酒精和水 | D. | 硝酸钾和氯化钾溶液 |
16.已知下列微粒在酸性溶液中还原性强弱的顺序是SO2>I->H2O2>Fe2+>Cl-,则下列反应不能发生的是
( )
( )
| A. | 2Fe2十+Cl2═2Fe3++2Cl- | B. | 2Fe2十+O2═2Fe3++2I- | ||
| C. | I2+SO2+2H2O═H2SO4+2HI | D. | SO2+O2+2H2O═H2O2+H2SO4 |
13.如表所示为部分短周期元素的原子半径及主要化合价,根据表中信息判断下列叙述正确的是( )
| 元素代号 | A | B | C | D | E | F | G |
| 原子半径/nm | 0.182 | 0.160 | 0.089 | 0.143 | 0.102 | 0.099 | 0.071 |
| 主要化合价 | +1 | +2 | +2 | +3 | +6、-2 | -1 | -1 |
| A. | D、B简单离子半径大小关系为D3+>B2+ | |
| B. | B2+、D3+、E2-、G-四种离子的核外电子排布相同 | |
| C. | 最高价氧化物对应的水化物的酸性:H2EO4>HFO4 | |
| D. | 气态氢化物的稳定性HG>HF>H2E |
20.反应:A2+B2≒2AB+QkJ在不同温度和不同压强时产物AB的生成情况如图,下列叙述正确的是( )

| A. | AB为气体,A2,B2均为气体 Q>0 | |
| B. | AB为气体,A2,B2其中有一种为气体,Q<0 | |
| C. | AB为气体,A2,B2其中有一种为气体,Q>0 | |
| D. | AB为气体,A2,B2其中至少有一种为气体,Q>0 |
17.下列叙述正确的是( )
| A. | 含最高价元素的化合物,一定具有氧化性 | |
| B. | 阳离子只有氧化性,阴离子只有还原性 | |
| C. | 失电子越多,还原性越强 | |
| D. | 一种物质是氧化剂时,同时必然有另一种物质是还原剂 |