题目内容
7.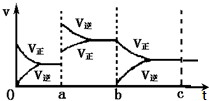 如图表示在密闭容器中反应:2SO2+O2?2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是升温;bc过程与ab过程相比化学平衡常数不变.(填“增大”“减小”或“不变”)
如图表示在密闭容器中反应:2SO2+O2?2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是升温;bc过程与ab过程相比化学平衡常数不变.(填“增大”“减小”或“不变”)
分析 根据图二可知,在a时刻,正逆反应速率都增大,且逆反应速率大于正反应速率,即平衡逆向移动,因为反应的△H<0,根据影响化学反应速率和化学平衡的条件可知,a~b过程中改变的条件可能是升温;根据化学平衡常数仅与温度有关判断.
解答 解:根据图二可知,在a时刻,正逆反应速率都增大,且逆反应速率大于正反应速率,即平衡逆向移动,因为反应的△H<0,根据影响化学反应速率和化学平衡的条件可知,a~b过程中改变的条件可能是升温;在b时刻,正反应速率不变,逆反应速率减小,且正反应速率大于逆反应速率,即平衡正向移动,根据影响化学反应速率和化学平衡的条件可知,b~c过程中改变的条件可能是减小生成物C的浓度,所以温度没变,则bc过程与ab过程相比化学平衡常数不变;
故答案为:升温;不变.
点评 本题考查了影响反应速率和化学平衡移动的外界因素等知识,难度不大,在看图时要注间线的起点和正逆反应速率的相对大小,进而判断平衡移动方向.

练习册系列答案
相关题目
17.可逆反应 A(g)+B(g)?2C(g),温度为349K时,K=1;A的起始浓度为2mol•L-1,B的起始浓度为5mol•L-1时,在密闭容器达到平衡,B的转化率为( )
| A. | 80% | B. | 70% | C. | 50% | D. | 20% |
18.下列属于电解质是( )
| A. | 淀粉 | B. | KNO3溶液 | C. | 乙醇 | D. | 熔融的NaCl |
12.合成氨反应为N2+3H2≒2NH3,今有A、B、C、D四个容器,每个容器中有两种操作,两种操作分别达到平衡后,操作1中N2和操作2中NH3转化率之和一定不为1的是(起始体积相等)( )
| A. | 恒温恒容:操作1:加1mol N2+3mol H2,操作2:加2mol NH3 | |
| B. | 恒温恒压:操作1:加1mol N2+3mol H2,操作2:加2mol NH3 | |
| C. | 恒温恒容:操作1:加1mol N2+3mol H2,操作2:加3mol NH3 | |
| D. | 恒温恒压:操作1:加1mol N2+3mol H2,操作2:加3mol NH3 |
19.下列相关的表述不正确的是( )
| A. | 电解饱和食盐水的离子方程式:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| B. | 向淀粉KI溶液中滴加稀硫酸溶液变蓝:4I-+O2+4H+=2H2O+2I2 | |
| C. | 加入铝粉能产生氢气的溶液中可能存在大量的K+、Ba2+、AlO2-、Cl- | |
| D. | HCO3-水解的离子方程式:HCO3-+H2O=CO32-+H3O+ |