14.下列化学用语使用正确的是( )
| A. | 中子数为9的氧原子符号为16O | |
| B. | 某元素的一种原子质量数为X则该元素的相对原子质量为X | |
| C. | H、D、T三种核素化学性质不相同 | |
| D. | 次氯酸的结构式:H-O-Cl |
12. 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)═CH3OH(g).
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)═CH3OH(g).
(1)判断反应达到平衡状态的依据是cd(填序号).
a.生成CH3OH的速率与消耗CO的速率相等 b.混合气体的密度不变
c.混合气体的平均相对分子质量不变 d.CH3OH、CO、H2的浓度都不再发生变化
(2)下表所列数据是该反应在不同温度下的化学平衡常数(K)
①该反应的平衡常数表达式K=$\frac{c(CH{\;}_{3}OH)}{c(CO)c{\;}^{2}(H{\;}_{2})}$,△H<0(填“>”、“<”或“=”).
②要提高CO的转化率,可以采取的措施是df(填序号).
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2加压 e.加入惰性气体加压 f.分离出甲醇
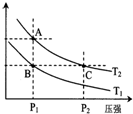
(3)如图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A<C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A=C,由状态B到状态A,可采用升温的方法(填“升温”或“降温”).
(4)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-akJ•mol-1;②2CO(g)+O2(g)═2CO2(g)△H=-bkJ•mol-1;③H2O(g)═H2O(l)△H=-ckJ•mol-1.写出1摩尔液态CH3OH不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H=$\frac{b-a-4c}{2}$kJ•mol-1.
 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)═CH3OH(g).
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)═CH3OH(g).(1)判断反应达到平衡状态的依据是cd(填序号).
a.生成CH3OH的速率与消耗CO的速率相等 b.混合气体的密度不变
c.混合气体的平均相对分子质量不变 d.CH3OH、CO、H2的浓度都不再发生变化
(2)下表所列数据是该反应在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②要提高CO的转化率,可以采取的措施是df(填序号).
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2加压 e.加入惰性气体加压 f.分离出甲醇
(3)如图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A<C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A=C,由状态B到状态A,可采用升温的方法(填“升温”或“降温”).
(4)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-akJ•mol-1;②2CO(g)+O2(g)═2CO2(g)△H=-bkJ•mol-1;③H2O(g)═H2O(l)△H=-ckJ•mol-1.写出1摩尔液态CH3OH不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H=$\frac{b-a-4c}{2}$kJ•mol-1.
11.现有常温下pH=2的盐酸甲和pH=2的醋酸溶液乙,请根据下列操作回答问题:
(1)将pH=2的醋酸溶液加水稀释过程,下列表达式的数据变大的是B.
A.c(H+) B.c(H+)/c(CH3COOH)$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-) D.$\frac{c({H}^{+})c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COO{H}^{-})}$
(2)相同条件下,取等体积的甲、乙两溶液,各稀释100倍.稀释后的溶液,其pH大小关系为:pH(甲)>pH(乙)( 填“>”、“<”或“=”).
(3)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(甲)< V(乙)( 填“>”、“<”或“=”).
(4)已知25℃时,两种酸的电离平衡常数如下:
下列四种离子结合H+能力最强的是B.原因是电离平衡常数越大,相应酸根结合氢离子的能力越小,则根据电离平衡常数可知结合H+能力最强的是CO32-.
A.HCO3- B.CO32- C.ClO- D.CH3COO-.
(1)将pH=2的醋酸溶液加水稀释过程,下列表达式的数据变大的是B.
A.c(H+) B.c(H+)/c(CH3COOH)$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-) D.$\frac{c({H}^{+})c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COO{H}^{-})}$
(2)相同条件下,取等体积的甲、乙两溶液,各稀释100倍.稀释后的溶液,其pH大小关系为:pH(甲)>pH(乙)( 填“>”、“<”或“=”).
(3)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(甲)< V(乙)( 填“>”、“<”或“=”).
(4)已知25℃时,两种酸的电离平衡常数如下:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数K1 | 1.8×10-5 | 4.3×10-7 | 3.0×10-8 |
| K2 | -- | 5.6×10-11 | -- |
A.HCO3- B.CO32- C.ClO- D.CH3COO-.
9.下列关于各图的叙述中正确的是( )


| A. | 图甲表示lmol H2(g)完全燃烧生成水蒸气吸收241.8kJ热量 | |
| B. | 图甲表示2mol H2(g)所具有的能量比2mol H2O(g)所具有的能量多483.6kJ | |
| C. | 图乙表示常温下稀释HA、HB两种酸的图象,得出结论:HA的酸性大于HB的酸性 | |
| D. | 图乙中起始时HA的物质的量浓度大于HB |
8.某一元强酸X和某一元弱酸Y的水溶液中,c(H+)均为1×10-2mol/L,各取这两种溶液10mL分别与足量金属镁反应.下列叙述中正确的是( )
| A. | 产生H2量:X>Y | B. | 反应消耗镁的量:X>Y | ||
| C. | 反应起始时速率:X=Y | D. | 反应一段时间后速率:X>Y |
7.将等物质的量的A、B混合于2L密闭容器中,发生如下反应3A(g)+B(g)?xC(g)+2D(g),经5min后测得D的浓度为0.5mol•L-1,c(A):c(B)=3:5,用C的浓度变化表示的平均反应速率为0.1mol•L-1•min-1.下列有关结论正确的是( )
| A. | x的值为1 | B. | v(B)=0.2mol•L-1•min-1 | ||
| C. | 反应开始前A的物质的量为3mol | D. | 5min时A的浓度为0.2mol•L-1 |
6.下列对于水的电离平衡叙述不正确的是( )
| A. | 将水加热,pH减小 | |
| B. | 恒温下,向水中加入少量固体KOH,Kw不变 | |
| C. | 向水中加入金属钠,c(H+)减小 | |
| D. | 向水中通入氯化氢气体,平衡正向移动 |
5.下列说法正确的一组是( )
①不溶于水的盐(CaCO3、BaSO4等)都是弱电解质
②pH=1的强酸溶液,加水稀释后,溶液中所有离子浓度都降低
③反应4A (g)+B(g)═2C(g)+D(g)不能自发进行,则该反应△H一定小于0
④溶液、胶体、浊液三种分散系可用丁达尔效应进行区分
⑤熔融的电解质都能导电
⑥勒夏特列原理用于判断可逆反应是否达到平衡状态.
0 173107 173115 173121 173125 173131 173133 173137 173143 173145 173151 173157 173161 173163 173167 173173 173175 173181 173185 173187 173191 173193 173197 173199 173201 173202 173203 173205 173206 173207 173209 173211 173215 173217 173221 173223 173227 173233 173235 173241 173245 173247 173251 173257 173263 173265 173271 173275 173277 173283 173287 173293 173301 203614
①不溶于水的盐(CaCO3、BaSO4等)都是弱电解质
②pH=1的强酸溶液,加水稀释后,溶液中所有离子浓度都降低
③反应4A (g)+B(g)═2C(g)+D(g)不能自发进行,则该反应△H一定小于0
④溶液、胶体、浊液三种分散系可用丁达尔效应进行区分
⑤熔融的电解质都能导电
⑥勒夏特列原理用于判断可逆反应是否达到平衡状态.
| A. | ①③⑤⑥ | B. | ②④⑤⑥ | C. | 只有⑤ | D. | 均不对 |
 .原子序数比Y多2的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.X与Y能形成多种化合物,其中一种含有10电子的化合物是CH4,该化合物可与氧气在碱性溶液的条件下形成原电池供能,写出负极涉及的电极方程式CH4-8e-+10OH-=CO32-+7H2O.
.原子序数比Y多2的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.X与Y能形成多种化合物,其中一种含有10电子的化合物是CH4,该化合物可与氧气在碱性溶液的条件下形成原电池供能,写出负极涉及的电极方程式CH4-8e-+10OH-=CO32-+7H2O.