题目内容
8.某一元强酸X和某一元弱酸Y的水溶液中,c(H+)均为1×10-2mol/L,各取这两种溶液10mL分别与足量金属镁反应.下列叙述中正确的是( )| A. | 产生H2量:X>Y | B. | 反应消耗镁的量:X>Y | ||
| C. | 反应起始时速率:X=Y | D. | 反应一段时间后速率:X>Y |
分析 一元强酸X溶液和一元弱酸Y溶液各10mL,c(H+)均为1×10-2mol/L,则所含酸的物质的量Y>X,足量金属镁反应产生氢气的物质的量Y>X,氢离子浓度相同,开始时反应速率X=Y,反应一段时间后X中氢离子浓度下降得快,Y中氢离子浓度下降得慢,反应速率X<Y,据此分析.
解答 解:A、足量金属镁反应产生氢气的物质的量Y>X,故A错误;
B、由于所含酸的物质的量Y>X,所以消耗Mg的量Y>X,故B错误;
C、c(H+)均为1×10-2mol/L,氢离子浓度相同,开始时反应速率X=Y,故C正确;
D、反应一段时间后X中氢离子浓度下降得快,Y中氢离子浓度下降得慢,反应速率X<Y,故D正确;
故选C.
点评 本题考查了影响反应速率的因素,注意相同c(H+)相同体积的一元强酸和弱酸所含酸的物质的量弱酸大于强酸,难度不大.

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案
相关题目
16.下列关于实验基本操作的叙述不正确的是( )
| A. | 使用分液漏斗和容量瓶时,首先要查漏 | |
| B. | 蒸馏实验中,要在烧瓶中加入几粒沸石或碎瓷片,以防止液体暴沸 | |
| C. | 向试管中加液体时,胶头滴管不能紧贴试管内壁 | |
| D. | 用蒸发皿进行加热蒸发时,一定要垫石棉网 |
3.用NA表示阿伏伽德罗常数的值.下列叙述正确的是( )
| A. | 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | 标准状况下,2.24LCl2与足量水应,消耗1.8g H2O | |
| C. | 已知有N2(g)+3H2(g)?2NH3(g)△H=-92.0kJ•mol-1,如果该反应吸收的能量为46.0kJ,则形成N-H键的数目为3NA | |
| D. | 32g铜和足量硫完全反应,生成Cu2S,转移的电子数为0.5NA |
20.下列各图所示的实验原理、方法、装置或操作正确的是( )
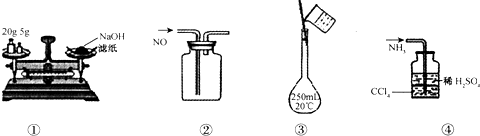

| A. | ①称量氢氧化钠固体 | B. | ②收集NO气体 | ||
| C. | ③配制100 mL 0.10 mol•L-1盐酸 | D. | ④吸收NH3不会造成倒吸 |
17.在以下各种情形下,下列电离方程式的书写正确的是( )
| A. | 熔融状态下的NaHSO4电离:NaHSO4═Na++H++SO42- | |
| B. | H2CO3的电离:H2CO3═2H++CO32- | |
| C. | 水溶液中的NaHCO3电离:NaHCO3═Na++HCO3- | |
| D. | 水溶液中的Fe(OH)3电离:Fe(OH)3═Fe3++3OH- |