题目内容
7.将等物质的量的A、B混合于2L密闭容器中,发生如下反应3A(g)+B(g)?xC(g)+2D(g),经5min后测得D的浓度为0.5mol•L-1,c(A):c(B)=3:5,用C的浓度变化表示的平均反应速率为0.1mol•L-1•min-1.下列有关结论正确的是( )| A. | x的值为1 | B. | v(B)=0.2mol•L-1•min-1 | ||
| C. | 反应开始前A的物质的量为3mol | D. | 5min时A的浓度为0.2mol•L-1 |
分析 A.根据v=$\frac{△c}{△t}$计算v(D),再根据反应速率之比等于化学计量数之比计算x的值;
B.结合v(D),利用反应速率之比等于化学计量数之比计算v(B);
C.5min后,测得D的浓度为0.5mol•L-1,则生成的D为0.5mol/L×2L=1mol,设开始A、B的物质的量均为n,表示出5min时A、B的物质的量,再根据A、B浓度之比列方程计算A、B起始物质的量
D.结合C中计算数据计算5min时A的浓度.
解答 解:A.经5min后,测得D的浓度为0.5mol•L-1,则v(D)=$\frac{0.5mol/L}{5min}$=0.1mol/(L•min),C的平均反应速率是0.1mol/(L•min),则0.1mol/(L•min):0.1mol/(L•min)=2:x,解得x=2,故A错误;
B.反应速率之比等于化学计量数之比,则v(B)=$\frac{1}{2}$v(D)=0.05mol/(L•min),故B错误;
C.5min后,测得D的浓度为0.5mol•L-1,则生成的D为0.5mol/L×2L=1mol,设开始A、B的物质的量均为n,则:
3A(g)+B(g)?xC(g)+2D(g)
开始(mol):n n 0
转化(mol):1.5 0.5 1
5min时(mol):n-1.5 n-0.5 1
此时A、B的物质的量浓度之比为3:5,则(n-1.5):(n-0.5)=3:5,解得n=3,故C正确;
D.根据C中计算可知,5min时A的浓度为$\frac{(3-1.5)mol}{2L}$=0.75mol/L,故D错误,
故选:C.
点评 本题考查化学平衡的计算、化学反应速率计算,难度不大,注意三段式在化学平衡计算中应用,根据反应速率定义式理解速率规律.

| A. | 2A+B?2C | B. | A+B?2C | C. | 2A+B?C | D. | 2A+B?4C |
| A. | 1molAl3+离子含有的电子数为3NA | |
| B. | 1molCl2含有1NA个原子 | |
| C. | 58.5g氯化钠固体中,含1NA个阴离子 | |
| D. | 欲配制1.00L 1.00mol•L-1的NaCl溶液,可将58.5gNaCl溶于1.00L水中 |
| A. | 反应产物的总能量大于反应物的总能量时,△H<0 | |
| B. | 已知反应H2(g)+I2(g)?2HI(g)平衡常数为K,则2H2(g)+2I2(g)?4HI(g)的平衡常数为2K | |
| C. | △H<0、△S>0的反应在温度低时不能自发进行 | |
| D. | 在其他外界条件不变的情况下,使用催化剂,不能改变化学反应进行的方向 |
 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)═CH3OH(g).
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)═CH3OH(g).(1)判断反应达到平衡状态的依据是cd(填序号).
a.生成CH3OH的速率与消耗CO的速率相等 b.混合气体的密度不变
c.混合气体的平均相对分子质量不变 d.CH3OH、CO、H2的浓度都不再发生变化
(2)下表所列数据是该反应在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②要提高CO的转化率,可以采取的措施是df(填序号).
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2加压 e.加入惰性气体加压 f.分离出甲醇
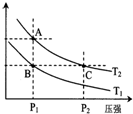
(3)如图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A<C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A=C,由状态B到状态A,可采用升温的方法(填“升温”或“降温”).
(4)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-akJ•mol-1;②2CO(g)+O2(g)═2CO2(g)△H=-bkJ•mol-1;③H2O(g)═H2O(l)△H=-ckJ•mol-1.写出1摩尔液态CH3OH不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H=$\frac{b-a-4c}{2}$kJ•mol-1.
| A. | Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-=2Fe2++I2+3H2O | |
| B. | Ca(HCO3)2溶液与过量NaOH溶液反应:HCO${\;}_{3}^{-}$+Ca2++OH-═CaCO3↓+H2O | |
| C. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO${\;}_{4}^{-}$+6H++5H2O2=2Mn2++5O2↑+8H2O | |
| D. | AlCl3溶液与过量的浓氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O |
| A. | 水蒸气变为液态水时,焓变△H<0 | |
| B. | 对于△H<0的反应,反应物的总焓大于生成物的总焓 | |
| C. | 需要持续加热才能进行的反应△H一定大于0 | |
| D. | Ba(OH)2•8H2O和NH4Cl固体反应,反应物的总键能小于生成物的总键能 |

 ,当有0.1mol的Fe2+生成时,转移电子数目为0.1NA.
,当有0.1mol的Fe2+生成时,转移电子数目为0.1NA.