16.已知H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1.下列说法中不正确的是( )
| A. | H2燃烧放出的热量为241.8kJ | |
| B. | 2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ•mol-1 | |
| C. | 1molH2完全燃烧生成液态水放出的热量小于241.8kJ | |
| D. | 断开1mol H20的化学键吸收的总能量大于断裂1mol H2和0.5mol 02的化学键所吸收的总能量 |
15.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A. | pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 0.1mol•L-1 CH3COONa溶液与0.1mol•L-1 CH3COOH溶液等体积混合(pH=4.75):c(CH3COO-)+c(CH3COOH)=2c(Na+) | |
| C. | 0.1mol•L-1 CH3COONa溶液与0.1mol•L-1 HCl溶液混合至pH=7:c(Na+)>c(Cl-)=c(CH3COOH)>c(CH3COO-) | |
| D. | 0.1mol•L-1 Na2CO3溶液与0.1mol•L-1 NaHCO3溶液等体积混合:c(HCO3)+2c(H+)+3c(H2CO3)=c(CO32-)+2c(OH-) |
13.欲从氯化镁固体中除去少量氯化铝,应进行下列哪些操作( )
①加入过量氨水②加入过量氢氧化钠溶液③加入过量盐酸④加入过量硫酸⑤溶解⑥过滤⑦蒸发结晶.
①加入过量氨水②加入过量氢氧化钠溶液③加入过量盐酸④加入过量硫酸⑤溶解⑥过滤⑦蒸发结晶.
| A. | ⑤①⑥③⑦ | B. | ⑤②⑥③⑦ | C. | ⑤②⑥④⑦ | D. | ⑤①⑥④⑦ |
12.要使10mL0.05mol•L-1H2SO4溶液的pH增大2,下列方法不可行的是( )
| A. | 向溶液中加入适量氯化铵固体 | |
| B. | 向溶液中加入一定体积的pH=4的盐酸 | |
| C. | 向溶液中加水至溶液体积为1000mL | |
| D. | 向溶液中加入适量醋酸钠固体 |
10.下列物质中,属于氧化物的是( )
| A. | NaHCO3 | B. | NaAlO2 | C. | CaCO3 | D. | CO |
8.下列有关混合物分离方法和原理分析都正确的是( )
| 选项 | 操作方法 | 实验原理 |
| A | 铁粉中混有少量铝粉:溶于浓氢氧化钠溶液,过滤 | 铝粉与氢氧化钠溶液反应,铁粉不和氢氧化钠溶液反应 |
| B | 氯化亚铁溶液中混有氯化铁:加入足量铜粉,过滤 | 铜能将Fe3+还原成Fe2+,铜与Fe2+不反应 |
| C | 过氧化钠中混有氧化钠:在空气中灼烧固体 | 氧化钠与氧气在加热条件下生成过氧化钠 |
| D | 氯化铝溶液中混有氯化镁:加入足量氢氧化铝,过滤 | 氯化镁水解生成盐酸,盐酸与氢氧化铝反应,促进Mg2+完全水解 |
| A. | A | B. | B | C. | C | D. | D |
7.甲~庚等元素在周期表中的相对位置如下表,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断正确的是( )
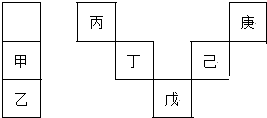
0 173085 173093 173099 173103 173109 173111 173115 173121 173123 173129 173135 173139 173141 173145 173151 173153 173159 173163 173165 173169 173171 173175 173177 173179 173180 173181 173183 173184 173185 173187 173189 173193 173195 173199 173201 173205 173211 173213 173219 173223 173225 173229 173235 173241 173243 173249 173253 173255 173261 173265 173271 173279 203614

| A. | 丙与戊的原子序数相差28 | |
| B. | 气态氢化物的稳定性:庚<己<戊 | |
| C. | 常温下,庚和乙形成的化合物易溶于水 | |
| D. | 丁的最高价氧化物不与任何酸反应 |
