题目内容
12.要使10mL0.05mol•L-1H2SO4溶液的pH增大2,下列方法不可行的是( )| A. | 向溶液中加入适量氯化铵固体 | |
| B. | 向溶液中加入一定体积的pH=4的盐酸 | |
| C. | 向溶液中加水至溶液体积为1000mL | |
| D. | 向溶液中加入适量醋酸钠固体 |
分析 10mL0.05mol•L-1H2SO4溶液中c(H+)=0.1mol/L,pH=1,若使溶液的pH增大2,需要减小氢离子的浓度.
解答 解:10mL0.05mol•L-1H2SO4溶液中c(H+)=0.1mol/L,pH=1,若使溶液的pH增大2,需要减小氢离子的浓度,
A.向溶液中加入适量氯化铵固体,溶液中氢离子浓度几乎不变,所以不能使pH增大2,故A错误;
B.pH=1的溶液,若使溶液的pH增大2,可以加入一定体积的pH=4的盐酸,故B正确;
C.pH=1的溶液,向溶液中加水至溶液体积为1000mL,体积增大为原来的100倍,则氢离子浓度减小为原来的$\frac{1}{100}$,则溶液的pH增大2,故C正确;
D.pH=1的硫酸溶液,加入醋酸钠,pH增大,所以向溶液中加入适量醋酸钠固体可以使溶液的pH增大2,故D正确.
故选A.
点评 本题考查了弱电解质的电离、混合溶液的定性分析,题目难度不大,注意溶液中pH增大2,则氢离子浓度变为原来的$\frac{1}{100}$.

练习册系列答案
 每课必练系列答案
每课必练系列答案
相关题目
2.能表示阿伏加德罗常数数值的是( )
| A. | 1 mol金属钠含有的电子数 | |
| B. | 1 L 1 mol/L硫酸溶液所含的H+数 | |
| C. | 标准状况下,22.4 L四氯化碳所含的分子数 | |
| D. | 0.012 kg 12C所含的原子数 |
20.下列各组离子在特定条件下能够大量共存的是( )
| A. | 在使石蕊试液变红的溶液中:Na+、NH4+、NO3-、AlO2- | |
| B. | 在含有较多Al3+的溶液中:Na+、K+、SO42-、HCO3- | |
| C. | 室温下,在$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液中:K+、I-、Cl-、HS- | |
| D. | 在无色溶液中:SO42-、Cl-、NH4+、Na+ |
7.甲~庚等元素在周期表中的相对位置如下表,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断正确的是( )
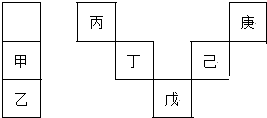

| A. | 丙与戊的原子序数相差28 | |
| B. | 气态氢化物的稳定性:庚<己<戊 | |
| C. | 常温下,庚和乙形成的化合物易溶于水 | |
| D. | 丁的最高价氧化物不与任何酸反应 |
17.溴化碘(IBr)是一种卤素互化物,它的化学性质活泼,能与大多数金属反应,也能与某些分金属单质反应,并能与水发生如下反应:IBr+H2O→HBr+HIO,下列有关溴化碘的叙述不正确的是( )
| A. | 溴化碘与Br2、I2具有相似的化学性质 | |
| B. | 在许多反应中,IBr是一种强氧化剂 | |
| C. | 在溴化碘与水反应中,IBr既是氧化剂,又是还原剂 | |
| D. | 溴化碘与氢氧化钠溶液反应时可生成两种盐 |
2.如表是元素周期表的一部分,回答下列有关问题:
(1)写出下列元素符号:①N,⑥Si,⑦S.
(2)画出原子的结构示意图:④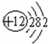 ,⑧
,⑧ ;
;
(3)在表中有编号的元素中,金属性最强的元素是K,非金属性最强的元素是F,用电子式表示它们形成化合物的过程 .最不活泼的元素是Ar.(以上均填元素名称)
.最不活泼的元素是Ar.(以上均填元素名称)
(4)元素③、⑩、的氢氧化物碱性由强到弱的顺序KOH>NaOH;元素⑥、⑦、⑧的氢化物稳定性由弱到强的顺序SiH4<H2S<HCl(均用化学式填空)
(5)周期中有一种元素,其最高价氧化物的水化物与同周期其它元素最高价氧化物的水化物所属物质类型都不同,用离子方程式表示该水化物分别与烧碱溶液和稀硫酸的反应:Al(OH)3+OH-=AlO2-+2H2O、Al(OH)3+3H+=Al3++3H2O;.
(6)与①和⑥都相邻的一种元素A,它有多种不同形态的单质,其中一种常用作原电池的电极,它与⑦的最高价氧化物的水化物浓溶液在加热时能反应,写出化学反应方程式:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O
(7)写出能验证⑦的非金属性强于A的化学反应的离子方程式:CO32-+2H+=CO2↑+H2O.
 | ⅠA | ⅡA | ⅢA | ⅠVA | VA | VⅠA | VⅡA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ |
(2)画出原子的结构示意图:④
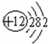 ,⑧
,⑧ ;
;(3)在表中有编号的元素中,金属性最强的元素是K,非金属性最强的元素是F,用电子式表示它们形成化合物的过程
 .最不活泼的元素是Ar.(以上均填元素名称)
.最不活泼的元素是Ar.(以上均填元素名称)(4)元素③、⑩、的氢氧化物碱性由强到弱的顺序KOH>NaOH;元素⑥、⑦、⑧的氢化物稳定性由弱到强的顺序SiH4<H2S<HCl(均用化学式填空)
(5)周期中有一种元素,其最高价氧化物的水化物与同周期其它元素最高价氧化物的水化物所属物质类型都不同,用离子方程式表示该水化物分别与烧碱溶液和稀硫酸的反应:Al(OH)3+OH-=AlO2-+2H2O、Al(OH)3+3H+=Al3++3H2O;.
(6)与①和⑥都相邻的一种元素A,它有多种不同形态的单质,其中一种常用作原电池的电极,它与⑦的最高价氧化物的水化物浓溶液在加热时能反应,写出化学反应方程式:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O
(7)写出能验证⑦的非金属性强于A的化学反应的离子方程式:CO32-+2H+=CO2↑+H2O.
19.下列有关说法正确的是( )
| A. | 在同温同压下,相同体积的任何气体含有相同数目的原子 | |
| B. | 氧化还原反应的本质是有电子转移 | |
| C. | Na2SO4溶液在电流作用下电离出Na+与SO42-而导电 | |
| D. | NaCl固体不导电,所以NaCl不是电解质 |
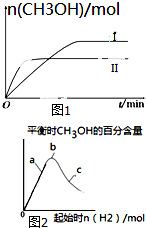 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.