16.T℃时在2L 密闭容器中使X(g)与Y(g)发生反应生成Z(g).反应过程中X、Y、Z 的浓度变化如图1 所示;若保持其他条件不变,温度分别为T1和T2 时,Y 的体积百分含量与时间的关系如图 2 所示.则下列结论不正确的是( )


| A. | 反应进行的前3 min 内,用X 表示的反应速率υ(X)=0.1 mol•L-1•min-1 | |
| B. | 容器中发生的反应可表示为:3X(g)+Y(g)?2Z(g) | |
| C. | 保持其他条件不变,升高温度,反应的化学平衡常数K 增大 | |
| D. | 若在相同条件下充入4.0molX,3.2molY,0.8molZ,达到平衡后X 的转化率为30% |
15.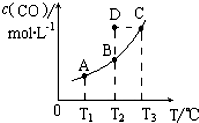 在恒容密闭容器中存在下列平衡:C(s)+H2O(g)?CO(g)+H2(g)的平衡物质的量浓度与温度 T的关系如图所示.下列说法错误的是( )
在恒容密闭容器中存在下列平衡:C(s)+H2O(g)?CO(g)+H2(g)的平衡物质的量浓度与温度 T的关系如图所示.下列说法错误的是( )
 在恒容密闭容器中存在下列平衡:C(s)+H2O(g)?CO(g)+H2(g)的平衡物质的量浓度与温度 T的关系如图所示.下列说法错误的是( )
在恒容密闭容器中存在下列平衡:C(s)+H2O(g)?CO(g)+H2(g)的平衡物质的量浓度与温度 T的关系如图所示.下列说法错误的是( )| A. | 该反应的△H>0 | |
| B. | 若T1、T2 时的平衡常数分别为K1、K2,则K1=K2 | |
| C. | 通过加热可以使B 点变到C 点 | |
| D. | 在T2时若反应进行到状态D,则一定有υ(正)<υ(逆) |
14.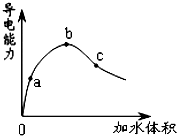 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示.下列说法不正确的是( )
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示.下列说法不正确的是( )
 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示.下列说法不正确的是( )
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示.下列说法不正确的是( )| A. | 在0 点时,醋酸不导电 | |
| B. | a、b、c 三点,a 点时醋酸溶液中氢离子浓度最小 | |
| C. | b 点时,醋酸电离程度最大 | |
| D. | 可通过微热的方法使c 点溶液中c(CH3COO-)增大 |
13.已知室温时,0.1mol•L-1 某一元酸 HA的水溶液 pH=4,则下列叙述错误的是( )
| A. | NaA 溶液呈碱性 | |
| B. | 升高温度,HA 溶液的pH 增大 | |
| C. | HA 电离平衡常数约为1×10-7 | |
| D. | 将该溶液稀释100 倍后,pH 介于4 至6 之间 |
12.一定量的盐酸跟过量的锌粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的 ①NaOH溶液 ②H2O ③CH3COONa固体 ④NaNO3溶液⑤稀硫酸( )
| A. | ②③ | B. | ②④ | C. | ②③④ | D. | ①②③④⑤ |
11.在2SO2(g)+O2(g)?2SO3(g)的平衡体系中,当分离出SO3后下列说法中正确的是( )
| A. | 正反应速率增大 | B. | 平衡常数增大 | ||
| C. | 正反应速率大于逆反应速率 | D. | 逆反应速率一直减小 |
10. 若将反应:Zn+H2SO4=ZnSO4+H2↑设计成原电池(如图),则下列说法不正确的是( )
若将反应:Zn+H2SO4=ZnSO4+H2↑设计成原电池(如图),则下列说法不正确的是( )
 若将反应:Zn+H2SO4=ZnSO4+H2↑设计成原电池(如图),则下列说法不正确的是( )
若将反应:Zn+H2SO4=ZnSO4+H2↑设计成原电池(如图),则下列说法不正确的是( )| A. | 该装置实现了化学能转化为电能 | B. | b 极表面发生了还原反应 | ||
| C. | c 溶液可以是ZnSO4 溶液 | D. | 盐桥中的Cl-移向右边烧杯 |
9.下列说法不正确的是( )
| A. | 增大压强,活化分子百分数不变,化学反应速率增大 | |
| B. | 升高温度,活化分子百分数增大,化学反应速率增大 | |
| C. | 增大反应物浓度,活化分子百分数增大,化学反应速率增大 | |
| D. | 使用催化剂,活化分子百分数增大,化学反应速率增大 |
8.常温下在水中加入下列物质,不会破坏水的电离平衡的是( )
| A. | 通入HCl 气体 | B. | 加入NaOH 固体 | C. | 加入蔗糖 | D. | 加入金属钠 |
7.某温度下,满足下列条件的溶液肯定呈酸性的是( )
0 173077 173085 173091 173095 173101 173103 173107 173113 173115 173121 173127 173131 173133 173137 173143 173145 173151 173155 173157 173161 173163 173167 173169 173171 173172 173173 173175 173176 173177 173179 173181 173185 173187 173191 173193 173197 173203 173205 173211 173215 173217 173221 173227 173233 173235 173241 173245 173247 173253 173257 173263 173271 203614
| A. | 加酚酞显无色的溶液 | B. | 与Al 反应放出H2 的溶液 | ||
| C. | pH<7 的溶液 | D. | c(H+)>c(OH-)的溶液 |