题目内容
10. 若将反应:Zn+H2SO4=ZnSO4+H2↑设计成原电池(如图),则下列说法不正确的是( )
若将反应:Zn+H2SO4=ZnSO4+H2↑设计成原电池(如图),则下列说法不正确的是( )| A. | 该装置实现了化学能转化为电能 | B. | b 极表面发生了还原反应 | ||
| C. | c 溶液可以是ZnSO4 溶液 | D. | 盐桥中的Cl-移向右边烧杯 |
分析 据电子移动方向可知,此原电池中a为负极,b为正极,则a为Zn,c溶液是ZnSO4 溶液,d溶液为H2SO4溶液,原电池中化学能转化为电能,正极b上发生还原反应,盐桥中的阴离子移向负极,据此分析.
解答 解:A、该装置是原电池,化学能转化为电能,故A正确;
B、b为正极,正极发生还原反应,故B正确;
C、a为负极,a为Zn,c溶液是ZnSO4 溶液,故C正确;
D、盐桥中的阴离子移向负极,移向左侧烧杯,故D错误;
故选D.
点评 本题考查了原电池,明确原电池反应特点、正负极及电解质溶液的判断方法即可解答,在原电池反应中,一般来说,失电子化合价升高的金属单质作负极、得电子化合价降低的电解质为电解质溶液中的电解质,题目难度不大.

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
20.使用石油热裂解的副产物CH4来制取CO和H2,其生产流程如图:
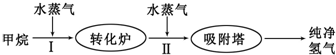
(1)工业上常利用反应Ⅰ产生的CO和H2合成可再生能源甲醇.
①已知CO(g)、CH3OH(l)的燃烧热分别为283.0kJ•mol-1和726.5kJ•mol-1,则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-443.5kJ•mol-1.
(2)此流程的第Ⅰ步反应为:CH4(g)+H2O(g)?CO(g)+3H2(g),一定条件下CH4的平衡转化率与温度、压强的关系如图1.则P1<P2.(填“<”、“>”或“=”)100℃时,将1mol CH4和2mol H2O通入容积为10L的恒容密闭容器中,达到平衡时CH4的转化率为0.5.此时该反应的平衡常数K=0.0225(或2.25×10-2).
(3)此流程的第Ⅱ步反应CO(g)+H2O(g)?CO2(g)+H2(g),的平衡常数随温度的变化如表:
从上表可以推断:该反应是放热(2分);(2分);反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,反应达到平衡时,CO的转化率为75%.图2表示该反应在t1时刻达到平衡、在t2时刻因改变某个条件引起浓度变化的情况:图2中t2时刻发生改变的条件是降低温度.增加水蒸汽的量或减少氢气的量(写出一种).
(4)某化学兴趣小组构想将NO转化为HNO3(NO3-),装置如图3,电极为多孔惰性材料.则负极的电极反应式是2H2O+NO-3e-=NO3-+4H+.
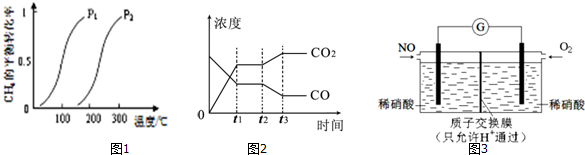

(1)工业上常利用反应Ⅰ产生的CO和H2合成可再生能源甲醇.
①已知CO(g)、CH3OH(l)的燃烧热分别为283.0kJ•mol-1和726.5kJ•mol-1,则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-443.5kJ•mol-1.
(2)此流程的第Ⅰ步反应为:CH4(g)+H2O(g)?CO(g)+3H2(g),一定条件下CH4的平衡转化率与温度、压强的关系如图1.则P1<P2.(填“<”、“>”或“=”)100℃时,将1mol CH4和2mol H2O通入容积为10L的恒容密闭容器中,达到平衡时CH4的转化率为0.5.此时该反应的平衡常数K=0.0225(或2.25×10-2).
(3)此流程的第Ⅱ步反应CO(g)+H2O(g)?CO2(g)+H2(g),的平衡常数随温度的变化如表:
| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
(4)某化学兴趣小组构想将NO转化为HNO3(NO3-),装置如图3,电极为多孔惰性材料.则负极的电极反应式是2H2O+NO-3e-=NO3-+4H+.

1.下列溶液中的c (Cl-)与50mL 1mol•L-1氯化铝溶液中的c (Cl-)相等的是( )
| A. | 150mL 1mol•L-1氯化钠溶液 | B. | 159mL 3mol•L-1氯化钾溶液 | ||
| C. | 75mL 1mol•L-1氯化镁溶液 | D. | 75mL 2mol•L-1氯化钙溶液 |
18.下列不是海水淡化主要方法的是( )
| A. | 蒸馏法 | B. | 离子交换法 | C. | 电渗析法 | D. | 干馏法 |
5.钢铁发生吸氧腐蚀时,正极发生的反应是( )
| A. | 2H++2e-═H2↑ | B. | 2H2O+O2+4e-═4OH- | ||
| C. | Fe-3e═Fe3+ | D. | Fe-2e═Fe2+ |
15.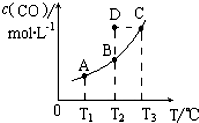 在恒容密闭容器中存在下列平衡:C(s)+H2O(g)?CO(g)+H2(g)的平衡物质的量浓度与温度 T的关系如图所示.下列说法错误的是( )
在恒容密闭容器中存在下列平衡:C(s)+H2O(g)?CO(g)+H2(g)的平衡物质的量浓度与温度 T的关系如图所示.下列说法错误的是( )
 在恒容密闭容器中存在下列平衡:C(s)+H2O(g)?CO(g)+H2(g)的平衡物质的量浓度与温度 T的关系如图所示.下列说法错误的是( )
在恒容密闭容器中存在下列平衡:C(s)+H2O(g)?CO(g)+H2(g)的平衡物质的量浓度与温度 T的关系如图所示.下列说法错误的是( )| A. | 该反应的△H>0 | |
| B. | 若T1、T2 时的平衡常数分别为K1、K2,则K1=K2 | |
| C. | 通过加热可以使B 点变到C 点 | |
| D. | 在T2时若反应进行到状态D,则一定有υ(正)<υ(逆) |
2.能表示阿伏加德罗常数数值的是( )
| A. | 1 mol金属钠含有的电子数 | |
| B. | 1 L 1 mol/L硫酸溶液所含的H+数 | |
| C. | 标准状况下,22.4 L四氯化碳所含的分子数 | |
| D. | 0.012 kg 12C所含的原子数 |
19.下表为六种短周期元素的部分性质:
下列有关说法错误的是( )
| 元素代号 | X | Y | Z | Q | R | T |
| 原子半径/10-10m | 0.77 | 0.74 | 0.75 | 1.17 | 0.99 | 1.10 |
| 主要化合价 | +4、-4 | -2 | +5、-3 | +4、-4 | +7、-1 | +5、-3 |
| A. | X与Y可以形成阴离子XY32- | |
| B. | Z的氢化物的沸点比T的氢化物的沸点高 | |
| C. | 元素R的氧化物对应的水化物一定为强酸 | |
| D. | 由X形成的化合物XY2和XR4,其中XR4的沸点高 |
20.下列各组离子在特定条件下能够大量共存的是( )
| A. | 在使石蕊试液变红的溶液中:Na+、NH4+、NO3-、AlO2- | |
| B. | 在含有较多Al3+的溶液中:Na+、K+、SO42-、HCO3- | |
| C. | 室温下,在$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液中:K+、I-、Cl-、HS- | |
| D. | 在无色溶液中:SO42-、Cl-、NH4+、Na+ |